JACS | 上海药物所提出“反向水解糖测序策略”用于糖链序列解析
糖分子在生物体内具有重要生物学功能,其结构复杂性决定了其功能多样性,当前的糖结构解析技术难以满足高效、精准的糖序列解析。纳米孔技术作为单分子传感技术,凭借其高灵敏度、高时空分辨率、低成本和便携性,成功用于核酸测序,且在多肽和蛋白测序中展现巨大潜力。然而,聚糖单元的理化性质与核酸和蛋白相比差异较大,结构更为复杂,采用纳米孔进行糖测序被认为更具挑战性。
中国科学院上海药物研究所高召兵研究员领衔组建了多学科交叉的“糖测序联合攻关团队”,包括高召兵/夏冰清(纳米孔测序方向),文留青等(糖化学方向),程曦(计算生物学方向)等近二十位成员,致力于开发基于纳米孔的糖测序新技术。攻关团队通过改造α-溶血素纳米孔传感区域,首次建立了不同链长水平的聚糖官能团指纹图谱/库(J.Am.Chem.Soc.,2023,封面文章),并将糖链读长突破至十糖,实现了复杂聚糖的单糖分辨率和糖苷键区分的综合感知(J.Am.Chem.Soc.,2024,封面文章)。这些研究验证了纳米孔用于糖测序的可行性。基于此,团队在前期受邀发表的Perspective文章中,首次正式提出了纳米孔糖测序技术的概念,并系统性地提出潜在的糖测序技术路线(Chem.Sci. 2024)。
近期,高召兵团队在前期工作基础上,开发糖苷酶辅助的纳米孔糖测序新策略。该技术结合高灵敏度的纳米孔技术和高特异性的外切糖苷酶水解反应,通过纳米孔电信号变化和糖苷酶特异性实现糖序列信息的解析。该策略首次完成十个连续糖组成单元和糖苷键的准确解析,且对十糖序列读取的准确率达98%以上。特别值得指出的是,该研究原创性地提出"反向测序"原理,基于水解前后电信号的特征性变化进行序列判读和解析。基于水解的纳米孔糖测序策略概念验证的完成是研发纳米孔糖测序进程中的关键节点之一,相关内容研究以"Glycan Sequencing Based on Glycosidase-Assisted Nanopore Sensing"为题于2025年1月2日在Journal of the American Chemical Society上在线发表。
该工作采用团队前期设计的α-溶血素突变体M113R/T115A纳米孔作为传感器,通过系统优化进一步提高了糖分子检测的灵敏度和分辨率。团队以链长为十糖的poly-LacNAc为模式糖链,用两种特异性外切糖苷酶β-N-乙酰己糖苷酶(GlcNAcH)和β1-4半乳糖苷酶(GalH)组成水解酶体系,在完成酶动力学系统优化后,将糖苷酶水解反应与纳米孔传感偶联,开展糖链序列信息的解读。研究发现,随着外切酶的逐步水解反应的进行,待测糖链在纳米孔中所形成的特征电信号呈现阶梯式变化。该变化赋予研究人员灵感,基于物理学中“逆问题”模型的启发,团队首次提出了"反向测序"原创测序策略。具体来说,利用多样化的糖苷酶组成阵列水解系统,未知糖链经过纳米孔会产生初始电信号Φ。在特定的酶促水解之后,水解产物会穿过纳米孔,产生新的电信号Φ'。如果初始信号和新信号存在差异(ΔΦ),我们可以立即判断糖链非还原末端水解的发生,并追溯推断未知糖链的单糖组成和连接键型。该测序原理利用多种可提取和可比较的电信号特征,包括但不限于电流堵塞幅度ΔI1/I0、驻留时间Dwell time 和标准差Std,使未知糖链的测序也具有可行性。
为了验证该策略的可行性,研究人员首先利用M113R/T115A对模式糖链所有可能的水解产物所对应的标准品进行分辨率测试。测试结果显示:在3 M KCl,+100 mV检测条件下,十糖至三糖均可产生可逆且持续的电流阻断信号,不同读长的糖链事件群展现出明显位移,但由于较高电渗流作用力,该检测条件不适用于二糖与单糖。为了降低电渗流,简化测试过程,我们在1 M KCl,-40 mV检测条件下,获得了二糖的特征信号。在这两种检测条件下,单糖均不产生信号,从而为检测过程提供了“无干扰、易判读”的优势。这不仅减少了逐一水解过程中可能的背景干扰,还为研究人员快速判读反应终点提供了极大的便利。以上检测结果均提示该纳米孔检测系统适用于糖水解测序。基于此,研究人员开展了真实场景的测试。测试过程包括三个步骤:外切酶水解糖链、纳米孔检测和序列信息推断。首先,用外切糖苷酶从非还原端依次切割序列假定未知的糖链。本研究中,模式糖十糖被两种相关糖苷酶GlcNAcH和GalH交替水解。连续的水解导致电流堵塞信号的幅度发生逐步的显著变化。然后,基于水解反应和外切酶特异性推断糖分子序列信息。结果显示,底物糖链非还原端第一个单糖为β-1,4糖苷键连接的半乳糖(Gal),第二个单糖为β-1,3糖苷键连接的N-乙酰氨基葡萄糖(GlcNAc)。九步实验结果表明,该未知糖分子由β-1,3连接的LacNAc单元(Galβ1-4 GlcNAc)组成,这与其实际结构相符。由于是否发生反应是根据反应前后信号是否显著变化判断,所以即使水解不完全也不影响测序结果。
为提高该糖测序技术的通用性和高效性,团队开发了定制化机器学习算法,以实现自动化、无偏和实时检测。首先,基于样品诱导的电信号的各个特征参数计算二维概率分布以清晰识别水解前后的信号差异。每对水解前后分布间的差异用五个参数描述:KL divergence (KL), JS divergence (JS), Earth mover's distance (EMD), Overlap coefficient (OC), and Bhattacharyya distance (BD)。测试集生成的混淆矩阵显示,"是"(确认发生水解)和"否"(确认未发生水解)的预测准确率分别为100%和94%。进一步,团队设计了自动化糖测序流程,当测序流程循环结束后将自动输出完整糖链序列。质谱结果验证了纳米孔水解测序策略的可靠性。与薄层色谱(TLC)检测相比,该纳米孔检测系统的样品检测浓度降低100倍以上,识别时间比质谱(MS)和亲水相互作用色谱 - 高效液相色谱(HILIC-HPLC)快5倍以上。
该工作开发的基于纳米孔的糖水解测序新策略无需严格控制易位速率,克服了传统纳米孔链测序应用于糖序列解析中的部分缺陷,显著降低了测序复杂性。该策略充分利用外切糖苷酶的高效性、特异性和纳米孔传感器的灵敏度推导糖序列信息。首次提出的"反向测序"策略避免了对单糖和复杂糖分子电信号指纹图谱的依赖,避免了当前缺乏高分辨率和全面糖指纹数据库的限制。对未知糖链而言,水解辅助糖链测序前需获得外切酶并了解其特异性。未来工作将开发酶阵列系统以提高该方法的通用性,并将其与自动识别系统集成,降低操作者专业要求。纳米孔技术为糖质密码解析提供了新方法,这些进展将促进整个糖科学领域的发展。
上海药物所/上海科技大学/临港实验室联合培养博士生姚广大、上海药物所研究员夏冰清、上海药物所博士生魏芳瑜、南京大学硕士生王嘉鸿为本文共同第一作者;上海药物所硕士生杨钰婷、博士后马圣洲、博士生柯文军、李铁海研究员、程曦研究员为本文共同作者。上海药物所高召兵研究员、文留青研究员、夏冰清研究员,南京大学龙亿涛教授为本文共同通讯作者。本研究获上海市糖专项、国家自然科学基金、青促会人才基金、上海市科技创新行动计划基金、上海市启明星计划等项目的支持。
全文链接: https://pubs.acs.org/doi/10.1021/jacs.4c12940
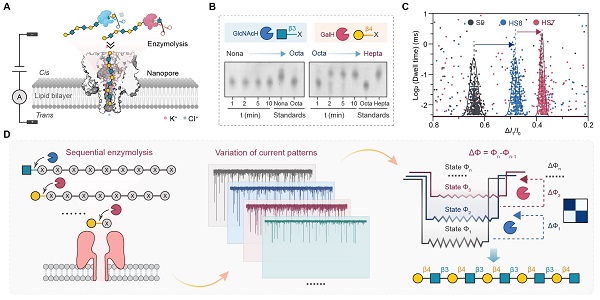
图1. 糖苷酶辅助纳米孔糖测序采用的“反向测序”原理
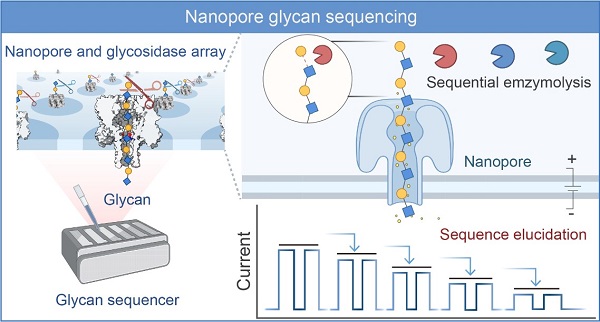
图2. 糖苷酶辅助的纳米孔糖测序技术