Nat Commun |上海药物所揭示E6AP活性动态调控分子机制
E6AP是HECT型泛素连接酶家族的创始成员,最初因与人乳头瘤病毒(human papillomavirus, HPV)的癌蛋白E6相互作用而被发现。来自高危型HPV的E6会劫持E6AP的泛素连接酶活性,导致肿瘤抑制因子p53的异常泛素化与降解,其结果与多种HPV阳性癌症的发生发展有关,包括超过90%的宫颈癌。HPV E6不仅能改变E6AP的底物,还能以未知的机制增强E6AP的活性。此外,E6AP活性的缺失/减弱和增强分别与天使综合征、自闭症谱系障碍有关。因此,研究E6AP的活性调控机制具有重要意义。
2024年4月26日,中国科学院上海药物研究所余学奎课题组联合罗成课题组在Nature Communications发表了题为“Structural insights into the functional mechanism of the ubiquitin ligase E6AP”的研究论文。该研究利用冷冻电镜技术分别解析了E6AP和E6结合E6AP不同构象复合物结构,并结合分子动力学模拟分析和生化实验,系统揭示了E6AP活性动态调控的分子机制。
在该项研究中,研究人员首先利用冷冻电镜技术,解析了E6AP/E6二元复合物的高分辨率结构,发现了复合物新颖的“dimer of dimer (protomer)”组装模式,每个protomer由一个E6AP和一个E6分子组成。其中,癌蛋白E6结合于E6AP表面由α1-helix和loop-helix-loop元件共同构成的、呈口袋构象的区域。在E6AP/E6复合物中,protomer间的二聚化主要通过E6AP 的α1-helix羧基端的疏水作用介导完成。此外,该研究还成功捕获了E6AP/E6五种不同状态的空间构象,并发现不同构象间protomer主要围绕α1-helix进行摆动,使得E6AP的催化结构域靠近或远离底物,为泛素转移提供结构空间,从而提示以上复合物结构代表了泛素转移的构象连续体。功能实验也进一步揭示了E6AP/E6 protomer的动态性和二聚化是E6AP实现底物泛素化的结构基础,且α1-helix在E6AP二聚化过程中扮演关键作用。在此基础上,该研究还解析了E6AP全长单体的冷冻电镜结构,与复合物中E6AP的结构比较发现,结合E6后的E6AP具有更长的α1-helix,分子动力学模拟分析也证实E6对E6AP α1-helix延伸区域具有稳定作用。
基于此,该研究首次提出E6对E6AP酶活性的动态调节机制:E6的结合能够诱导E6AP α1-helix的延长,进而促进E6AP的二聚化;在复合物中,两个E6AP/E6 protomer通过相互靠近或偏转,使得 E6AP的催化结构能够更高效地接近泛素偶联酶(Ubiquitin-conjugating enzymes,E2)以接受泛素,或接近底物p53以供给泛素。此外,该研究发现一些与天使综合征和自闭症谱系障碍相关的E6AP突变位于该延伸的α1-helix,提示出这些突变可能影响α1-helix的稳定性,进而导致E6AP功能障碍。该研究的结果为了解E6AP的生理和病理机制提供了关键的结构信息,并有助于开发针对E6AP功能障碍相关疾病的治疗干预措施。
上海药物所副研究员王振、博士研究生范凤英、国科大杭州高等研究副研究员李智海与浙江理工大学叶飞教授为本论文的共同第一作者,上海药物所余学奎研究员和罗成研究员为本论文的通讯作者。该项工作获得了上海药物所冷冻电镜研究中心的大力支持。该项目获得了国家重点研发计划、国家自然科学基金、杭州高等研究院研究基金与临港实验室等项目资助。
全文连接:https://www.nature.com/articles/s41467-024-47586-w
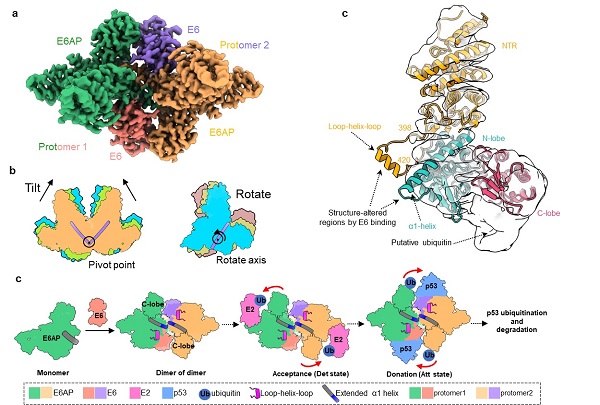
a,E6AP/E6复合物的整体结构(以Att1状态为代表,俯视图)。b,E6AP/E6复合物五种构象的比对示意图。两个E6AP/E6 protomer之间发生相互靠近或偏转的构象变化。c,E6AP/E6复合物的E6AP原子模型与单体E6AP的电子密度图比对。单体E6AP缺失α1-helix延长部分的电子密度,表明E6的结合诱导和/或稳定了α1-helix的延长。d,HPV E6劫持E6AP酶活性的模式图。
(供稿部门:余学奎课题组)







































































































































































































































