Cancer Cell | 上海药物所合作绘制无功能性胰腺神经内分泌瘤多组学分子图谱
胰腺神经内分泌瘤(PanNETs)是胰腺第二大常见肿瘤,其中约90%为无功能性(NF-PanNETs)。这类肿瘤早期没有症状,约半数患者确诊时已发生转移,特别是肝转移。且根治术后,PanNET 患者在胃肠胰神经内分泌瘤中最早复发,在临床上缺乏有效预测预后的分子标志物。目前,患者术后是否需要辅助治疗和随访周期不确定。此外,现有药物治疗方案,包括生长抑素类似物奥曲肽、舒尼替尼、依维莫司和替莫唑胺等,多数仅能改善无进展生存期(PFS),对总体生存期(OS)的改善有限。因此,亟需对NF-PanNETs的分子机制进行深入研究。
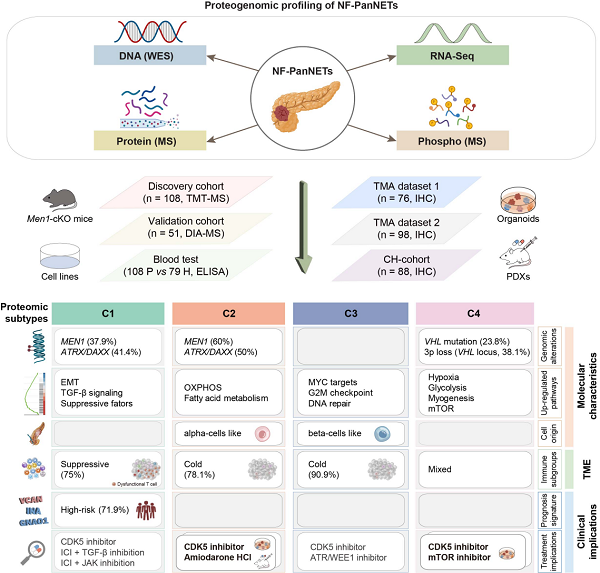
2025年4月3日,复旦大学附属肿瘤医院虞先濬团队联合北京大学肿瘤医院吴健民团队、中国科学院上海药物研究所周虎团队/质谱技术服务部、上海长海医院金刚团队、中国科学院分子细胞科学卓越创新中心高大明团队以及高栋团队,合作在Cancer Cell上发表了题为 “Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups”的研究论文。该研究历时五年攻关,整合基因组、转录组、蛋白质组和磷酸化修饰组四种组学数据,绘制了NF-PanNETs蛋白基因组学全景分子图谱,据此突破性地提出分子分型框架、预后模型和靶向-免疫治疗新策略,为胰腺神经内分泌瘤的精准诊疗提供了重要依据。
胰腺神经内分泌瘤多组学“全息图谱”:破解沉默肿瘤的终极密码
胰腺神经内分泌瘤的复杂性如同一部加密的“生命天书”,其高度异质性和治疗困境长期困扰医学界。团队通过对108例中国NF-PanNETs患者开展全外显子组、转录组、蛋白质组及磷酸化修饰组的多维度整合分析,绘制了NF-PanNETs的全景分子图谱,揭示了MEN1、ATRX、DAXX基因突变通过干扰染色质结构稳定性和激活mTOR通路驱动肿瘤恶性演进的机制,并通过MEN1基因条件性敲除小鼠模型验证了MEN1缺失触发代谢重编程和增殖信号交叉激活的恶性循环,从而导致染色体分离至关重要的CENPV 蛋白下调,填补了该领域机制研究的空白。另外,CDK5、WASL等基因的拷贝数扩增可作为NF-PanNET肿瘤生长的驱动因素,为靶向治疗提供了全新方向。
三蛋白预后模型:从实验室到临床精准诊疗的转化研究
在NF-PanNET患者的临床诊疗中,传统肿瘤分期及病理分级难以满足个体化治疗的需求。研究团队基于海量蛋白质组数据,利用前期研发的ReProMSig 平台基于人工智能算法筛选出GNAO1、INA、VCAN三个蛋白质,构建了预后标志物特征谱,为解决临床困境提供了重要工具。该模型在包含345例患者的四组独立队列中均展现出优良的预测效能和区分效果:高危患者五年生存率仅为51.4%,而低危组则高达97.8%。更具临床意义的是,团队证实分泌蛋白VCAN在患者血浆中的浓度与肿瘤进展显著相关,这一发现有望推动诊疗模式从“有创组织活检”向“无创血液检测”跨越。
分子分型:开启个体化精准治疗时代
研究团队通过蛋白质组学特征聚类,将NF-PanNET患者划分为四个分子亚型,为临床治疗提供了“按图索骥”的精准路线。其中C1亚型的肿瘤以免疫抑制微环境和EMT通路激活为特征,患者预后最差,急需探索免疫联合疗法;C2 亚型表现出异常活跃的氧化磷酸化活性; C3亚型由MYC 异常激活和失控的细胞周期信号主导;C4 亚型则在VHL突变驱动下形成独特的缺氧生态。基于各亚型特异激活的蛋白激酶和表达/活性上调蛋白,团队利用患者来源类器官(PDO)开展了药物筛选并利用患者来源肿瘤异种移植模型(PDX)进行验证,表明CDK5抑制剂可抑制多种亚型肿瘤生长;钙离子通道阻滞剂(如心血管疾病经典药物盐酸胺碘酮)与 CDK5 抑制剂两药联用在C2亚型中表现出更好的抑瘤效果;目前临床运用的mTOR 抑制剂可较好抑制C4 亚型肿瘤。这种“分型而治”的策略,为个体化精准治疗提供了科学依据。
综上,该研究是大规模胰腺神经内分泌瘤临床队列的多组学综合分析,研究成果为NF-PanNETs的发病机制解析、预后预测、分子分型及个体化治疗提供了坚实的理论依据,有望推动胰腺神经内分泌瘤研究领域的加速发展。
周虎课题组以高通量蛋白质组学技术为核心,整合多组学分析方法,通过多学科团队合作,在临床肿瘤蛋白质组学研究领域取得了一系列创新成果(Cell 2019, 2024;Cancer Cell 2022, 2025;National Science Review, 2023;Sci Transl Med,2023;Nat Commun,2024),为肿瘤的发生发展机制和潜在精准化靶向治疗方案提供了组学依据。
该研究也是依托于中国科学院上海药物所公共技术中心质谱技术服务部的重大科研服务成果产出。质谱技术服务部,配备多台不同类型的质谱仪器,具备中国合格评定国家认可委员会(CNAS)认可的分析检测能力,通过质谱检测方法学创新推动新药研发和生物医学研究进程。服务部面向所内外研究机构和企事业单位提供质谱支撑技术服务,开展大规模蛋白质鉴定及定量蛋白质组学检测、蛋白分子量、蛋白质翻译后修饰测定、蛋白相互作用交联质谱检测、化合物-蛋白互作、HDX氢氘交换、抗体表征从头测序、小分子质谱检测等多项技术服务。
复旦大学附属肿瘤医院虞先濬教授、北京大学肿瘤医院吴健民研究员、上海药物所周虎研究员、上海长海医院金刚教授和分子细胞科学卓越创新中心高大明研究员为该文共同通讯作者。复旦大学附属肿瘤医院吉顺荣主任医师、叶增博士与娄鑫博士,北京大学肿瘤医院曹丽华与杜阳助理研究员,上海药物所高婧正高级工程师,分子细胞科学卓越创新中心刘分博士和张晔晗博士为共同第一作者。该工作得到了分子细胞科学卓越创新中心徐亦舒博士、伦敦皇家自由医院胃肠病学与胃肠神经内分泌肿瘤中心主任Martyn Caplin教授、美国国立癌症研究院Henry Rodriguez博士、Ana I. Robles博士、华盛顿大学丁丽教授、美国贝勒医学院章冰教授、约翰斯-霍普金斯大学张会教授、耶鲁大学刘延盛教授的大力支持。该研究获得了国家自然科学基金委杰出青年科学基金项目、重大项目、科技部国家重点研发计划、上海市优秀学术带头人项目、上海市市级科技重大专项、中国科学院先导专项和技术支撑人才等项目的资助。
原文链接:https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00117-5
(供稿人:高婧;供稿部门:周虎课题组)







































































































































































































































