JCR | 上海药物所开展冻干细胞外囊泡用于干眼病的研究
2025年7月16日,中国科学院上海药物研究所张继稳团队在Journal of Controlled Release在线发表了题为“Alleviation of dry eye disease with lyophilized extracellular vesicles”的研究论文。
干眼病(DED)是一种常见的眼部疾病,全球数以百万计的人群受到影响,亟需开发新的治疗策略,实现有效治疗。细胞外囊泡(EVs)对DED有治疗潜力,但因储存稳定性等问题限制了临床应用。本研究提出一种新的策略,首次将天然渗透调节剂依克多因(ectoine)作为保护剂,应用于牛乳源细胞外囊泡(mEVs)的冻干处理,对冻干后mEVs的稳定性进行评价,并将冻干mEVs应用于DED的治疗研究。
本研究通过测定β-半乳糖苷酶(β-Gal)活性评估mEVs稳定性(图1 A-C),结果显示冻干处理后,依克多因组显著提高了β-Gal酶活性的保留。荧光共振能量转移(FRET)分析显示(图1 E-G),1.5%依克多因能维持DiO/DiI共标记mEVs的稳定能量转移效率。长期稳定性实验结果(图1 H,I)显示,不做任何处理的mEVs在4℃储存60天后,粒径明显增大,且颗粒数减少,而冻干mEVs在同样条件储存后粒径和颗粒数变化最小。在体外细胞实验中,冻干mEVs能有效保护人角膜上皮细胞免受高渗条件损伤。因此,依克多因能维持mEVs冻干后的结构稳定性,是一种极具潜力的冷冻保护剂。
接着,我们将冻干mEVs应用于DED的治疗进行药效学评估。采用0.15%苯扎氯铵(BAC)诱导新西兰兔DED模型,将造模的新西兰兔分为模型组(PBS)、单独依克多因组和冻干mEVs组。角膜染色评分显示(图2 C,D),冻干mEVs组角膜染色评分(1.50±1.64)显著低于单独依克多因组(4.80±2.40)和模型组(6.50±5.17),说明其促进角膜上皮修复的效果更优。泪液分泌测量显示(图2 B),冻干mEVs组(11.5±1.64mm)和单独依克多因组(11.0±1.29mm)均显著高于PBS组(6.00± 0.91mm),接近正常水平(13.2±2.12mm),表明冻干mEVs能促进DED兔的角膜和结膜修复,促进泪液分泌。
综上,本研究证明基于依克多因保护的冻干制剂是EVs的有效保存方法,为EVs的稳定储存提供了解决方案,促进了基于EVs治疗DED及其他眼部疾病的转化应用。
上海药物所任小红博士和沈阳药科大学-上海药物所联合培养硕士研究生林雪媛为本文共同第一作者,张继稳研究员为本文的通讯作者。
全文链接:https://doi.org/10.1016/j.jconrel.2025.114044
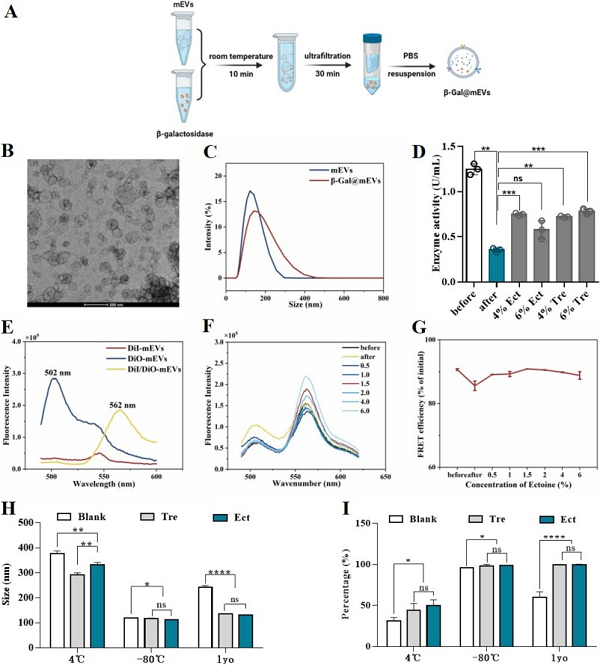
图1 冻干mEVs的稳定性分析
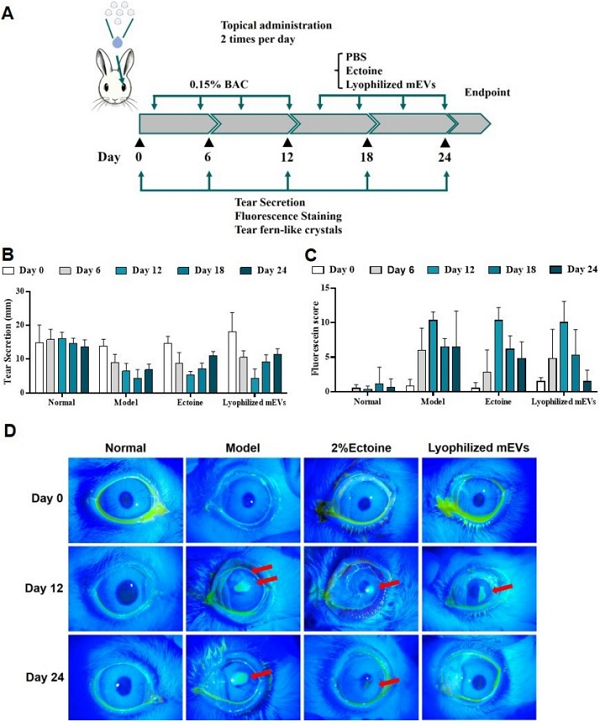
图2冻干mEVs对兔DED的治疗效果
(供稿部门:张继稳课题组;供稿人:任小红)







































































































































































































































