EMBO J | “鱼网”式固有免疫系统防御策略:酒亚明课题组发现巨噬细胞形成“树突状伪足”高效捕获细菌
2025年7月28日,酒亚明课题组联合多家科研机构,在EMBO Journal发表题为“Macrophages form dendrite-like pseudopods to enhance bacterial ingestion ”的文章,该研究利用多种显微成像技术和组学分析,首次揭示了巨噬细胞在严重革兰氏阴性菌感染时,会迅速生发出类似神经元树突的“树突状伪足”(Dendrite-like Pseudopods, DLPs),如同“鱼网”般扩大搜索范围以高效吞噬细菌,增强宿主抗菌防御。
在医疗、农业与全球公共卫生领域,革兰氏阴性菌正以前所未有的速度扩张其“版图”。它们不仅是医院中血流、伤口或手术部位感染的主要菌群,更在畜牧业、水产养殖与食品加工链条中造成大规模动物疫情与食源性暴发。尤为严峻的是,这类细菌具有天然外膜屏障与快速进化的获得性耐药机制,使碳青霉烯、多黏菌素等“最后防线”药物渐渐失效。多重耐药(MDR)甚至泛耐药(XDR)株的激增,直接导致重症监护室病死率飙升、器官移植与肿瘤化疗被迫推迟,并催生难以控制的跨国流行克隆。抗药性革兰氏阴性菌已从临床难题升级为全球性生物安全危机。面对这一局势,发掘全新的抗感染机制和策略迫在眉睫。
巨噬细胞作为重要的先天免疫细胞,被广泛认为在面临外源刺激时会发生显著的形变。对于细菌感染下巨噬细胞产生的细胞亚结构,目前的研究局限在较小程度的形态改变,如经典的丝状伪足(filopodia),板状伪足(lamellipodia),吞噬杯(phagocytic cup),膜褶皱(membrane ruffling)等,是否巨噬细胞存在特异的形态演变以匹配巨噬细胞的抗菌能力尚未有系统全面的研究。
研究团队利用高分辨率活细胞成像、微流控芯片和小鼠体内模型发现,当沙门氏菌感染达到一定强度时,巨噬细胞会经历显著的形态重构:原本趋向于形态非极化,通常表现为圆形的细胞,感染刺激后会伸出长达数十微米的树突状伪足(DLPs),这些伪足具有多级分支和膨大末端,与经典的丝状伪足和板状伪足截然不同。更重要的是,这些DLPs能够显著扩大巨噬细胞的“搜索半径”,使其更能够主动捕获远离细胞体的细菌(图1)。
进一步研究发现,革兰氏阴性菌外膜成分脂多糖(LPS)通过激活巨噬细胞表面的TLR4受体,启动NF-κB信号通路,上调巨噬细胞特异Rho鸟嘌呤核苷酸交换因子ARHGEF3的表达。ARHGEF3被招募至DLPs形成区域,激活RhoA GTP酶,驱动周期性肌动蛋白组装与解聚,形成DLPs的核心骨架;而中间丝蛋白vimentin则起到稳定DLPs结构的作用。LPS-TLR4-ARHGEF3-RhoA-vimentin信号轴确保了DLPs的高效形成与功能发挥。
在沙门氏菌感染的小鼠模型中,研究团队将体外诱导大量形成DLPs的巨噬细胞回输至感染小鼠体内,小鼠腹腔和肝脏中的细菌载量显著降低,感染症状明显缓解。此外,通过基因敲除或药物抑制ARHGEF3或vimentin,均可阻断DLPs形成,进而削弱巨噬细胞的抗感染能力,进一步验证了DLPs在宿主防御中的关键作用。
该研究不仅首次揭示了巨噬细胞在严重细菌感染下的形态学防御机制,更为抗耐药革兰氏阴性菌感染提供了潜在靶标。未来,通过调控ARHGEF3-RhoA-vimentin轴或回输DLPs增强的巨噬细胞,有望成为对抗耐药菌感染的有效手段(图2)。
全文链接:https://www.embopress.org/doi/full/10.1038/s44318-025-00515-z
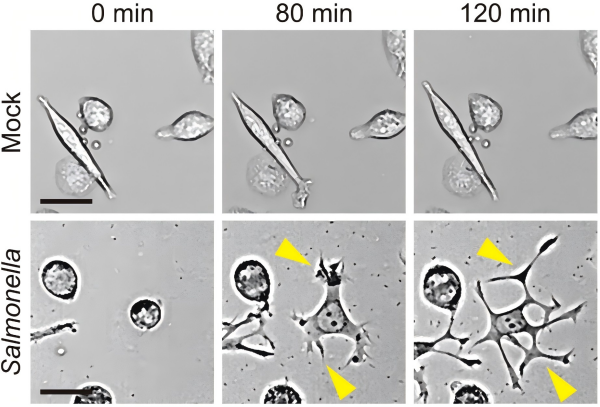
图1. 大量沙门氏菌感染诱发巨噬细胞产生树突状伪足
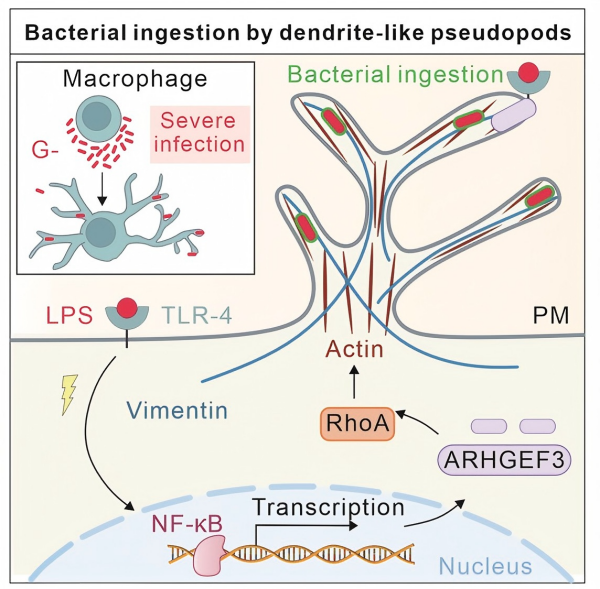
图2. 巨噬细胞产生DLPs的机制和功能
(供稿部门:酒亚明课题组)







































































































































































































































