G蛋白偶联受体:生命科学和药物研发的“宝藏”
人体由数十万亿细胞组成,不同细胞除了要独立参与各自的生命活动外,还是细胞“社会”群体里的一员。众多细胞通过通讯构成被严密调控的有机体。外界信号作用于细胞,引起细胞内代谢途径和基因表达等过程的变化,最终表现为细胞特定的生理改变,该过程被称为细胞的信号转导。
许多分子可以传导细胞信号,包括蛋白质、多肽、脂质、核苷酸等,甚至包括光和气味等也是重要的信号转导分子,这些信号分子统称为配体。配体必须与其特异的受体结合才能行使正常功能,而G蛋白偶联受体(Gprotein-coupled receptor, GPCR)正是人体内最大的细胞膜表面受体家族。
强光使人闭眼、花香使人愉悦、黑暗使人心跳加速……在人体的深处,细胞的表面,正是这些GPCR发挥着“传感器”的作用。正因为这些“聪明的GPCR”的存在,人们才能感知如此“缤纷多彩”的世界。
GPCR家族成员具有非常保守的空间结构。GPCR经过七次跨越细胞膜而镶嵌在细胞膜上,其起始端位于细胞膜外侧,而末端位于细胞内侧。配体与跨膜螺旋组成的特定结构——结合口袋结合,通过跨膜构象的变化,将信息传递到细胞内。配体的性质决定GPCR的状态,起激活作用的配体(激动剂)使受体活化,受体进一步与G蛋白异源三聚体偶联,将配体信号转导进细胞内;而起抑制作用的配体(抑制剂/拮抗剂)使原本活化的受体功能受到抑制。
除了在信号转导过程中发挥核心作用,GPCR也是药物开发领域的“明星”。癌症、心脏病、糖尿病、阿尔茨海默症等这些危害人类健康的重大疾病都与GPCR密不可分。当前约50%的上市药物作用于GPCR,但是在800多个GPCR成员里仅有约30个是已知药物的靶点,其余96%的GPCR作为药物靶点的潜力仍有待进一步开发。
高分辨率结构揭开了GPCR功能的神秘面纱
2007年,第一个人体内的GPCR的结构——β2肾上腺素受体的晶体结构的解析,开启了GPCR受体结构解析的新时代。随后新的GPCR结构陆续被解析;2011年,首个GPCR和下游效应蛋白复合物的高分辨率晶体结构——人β2肾上腺素受体与Gs异源三聚体复合物的高分辨率结构获得解析,首次揭示了GPCR激活下游Gs蛋白的分子机制,是GPCR研究领域的里程碑;2015年,中科院上海药物所徐华强研究员领衔的团队解析了首个视紫红质与视觉组遏蛋白(arrestin)完整复合物的晶体结构,破解了GPCR与其下游另一个关键信号蛋白——arrestin相互作用机制的科学难题;2017年,利用热门的冷冻电镜技术,科研人员解析了B类GPCR——降钙素受体和胰高血糖样肽-1受体(GLP-1R与Gs)效应蛋白复合物的三维结构,以及上海药物所科研人员测定了全长胰高血糖素受体(GCGR)高分辨率晶体结构。这些成果在B类GPCR激活机理领域具有重大理论意义,也为药物研发奠定了扎实的结构基础。
这些结构展示了GPCR在激动和抑制等多种状态下的空间构象,GPCR与其特异性配体结合的分子细节,揭示了GPCR与下游效应蛋白相互作用的分子机制,对理解GPCR结构和功能的关系,以及生命过程中信息传递机制提供了重要的理论依据。GPCR也为靶向药物研发提供了重要的结构模型。不同配体和小分子药物由于选择性低等问题,作用于疾病非关联GPCR引发“脱靶效应”,从而导致毒副作用。因此,小分子药物不仅能够发挥疗效,同时也是引起机体不良反应的诱因。GPCR结构所展示的GPCR与配体相互作用的高精度图像对设计新一代高效低毒的药物具有重大的现实意义,基于结构设计的高选择性GPCR靶向药物值得期待。
GPCR结构功能研究和药物研发的高地——中国科学院上海药物研究所
在“重大新药创制”国家科技重大专项支持下,“十二五”以来,中国科学院上海药物研究所组建了世界一流的GPCR结构与功能研究团队和技术平台。2010年,徐华强研究员受聘于上海药物所筹建GPCR结构生物学研究平台;2011年,两位年轻的GPCR结构生物学研究专家吴蓓丽和赵强博士加盟上海药物所;同时,国际GPCR结构生物学领军人物以外专身份加盟。通过与上海药物所药物设计与发现中心的蒋华良研究员团队、国家新药筛选中心王明伟研究员团队、iHuman、美国Scripps研究所和南加州大学等机构密切合作,在不到6年的时间内,GPCR结构生物学研究平台已经主导解析了人五羟色胺1B受体、CCR5趋化因子受体、P2Y12和P2Y1 嘌呤能受体、胰高血糖受体(GCGR)(包括跨膜区和全长)和胰高血糖样肽-1受体(GLP-1R)等9种与神经、免疫、心血管和代谢性疾病密切相关的GPCR结构,在国际顶级期刊《自然》和《科学》杂志上发表论文10余篇,实现了我国GPCR晶体结构测定“零”的突破,促使我国GPCR结构生物学研究迅速达到国际先进水平,跻身世界一流GPCR研究机构行列。
在GPCR结构和功能研究取得突破性进展的基础上,上海药物所进一步建立了基于GPCR靶标结构到药物研究的新研发模式。例如,基于CCR5趋化因子受体的结构,蒋华良、柳红、谢欣和吴蓓丽研究员等联合中科院昆明动物所郑永唐研究员,利用学科交叉的优势,在短时间内就得到药效和药代性质优于上市药物马拉维若的抗艾滋病候选新药,正在开展系统临床前研究。目前上海药物所已有1个调控多巴胺受体和5-羟色胺受体等多个GPCR功能的抗精神分裂症候选药物获得临床批件,3个靶向GPCR的候选新药即将完成临床前研究,并实施成果转让,快速实现了GPCR结构与功能基础研究向新药研发的转化。
尽管近年来已取得突破性进展,对GPCR的基础和应用研究仍然任重而道远。GPCR这块巨大的“宝藏”,仍有待生命科学、化学和药学家们的深入挖掘,而中国科学院上海药物研究所将继续为之不懈努力,在GPCR研究领域做出更大的贡献。
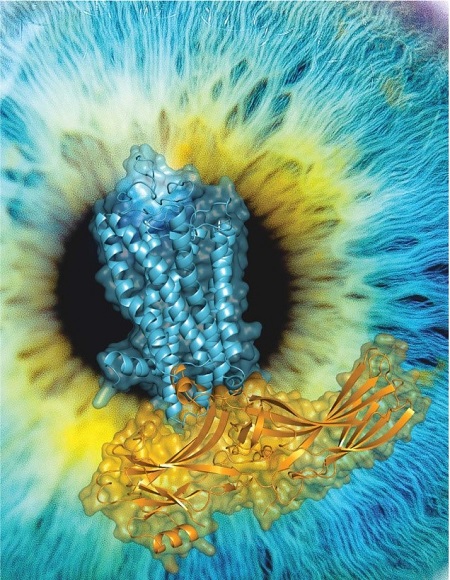
视紫红质和阻遏蛋白复合物的高分辨率三维结构。蓝色所示为视紫红质的结构;黄色所示为阻遏蛋白的结构。视紫红质感受外界光信号,并将光信号传导到细胞内,产生视觉。阻遏蛋白参与调控视觉的产生过程。
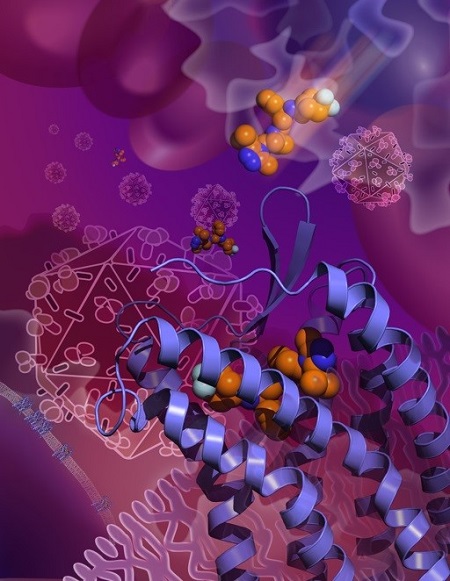
紫色螺旋为CCR5蛋白分子,中间橘黄色和蓝色小球是马拉维诺,外面多面体是艾滋病毒。抗艾滋病毒药物马拉维若通过与CCR5结合将其锁定在非活性状态,从而抵制艾滋病毒侵染人体细胞。
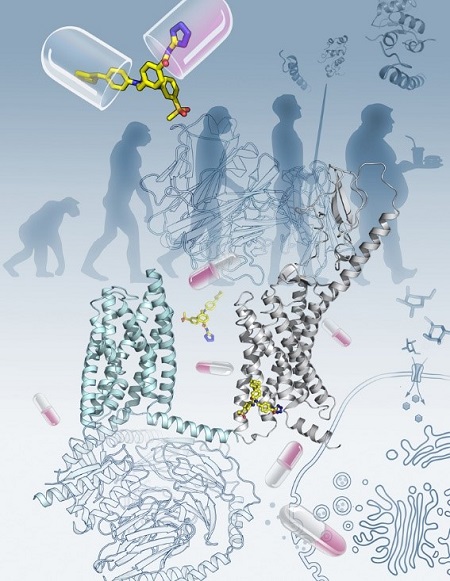
胰高血糖素受体GCGR参与调节体内血糖稳态,是治疗Ⅱ型糖尿病的重要靶点。右图为全长GCGR与抗体mAb1及拮抗剂NNC0640结合的复合物晶体结构,以灰色飘带表示,mAb1以浅灰色飘带表示,NNC0640用黄色棍棒表示。左图为最近发表于Nature的降血钙素受体CTR(青色飘带)与G蛋白(浅灰色飘带)结合的复合物电镜结构。上述两项研究是近期B型GPCR研究领域的最新进展。
(供稿部门:徐华强课题组;供稿人:蒋轶)







































































































































































































































