JMC | 上海药物所发展仿生模块化策略助力流感病毒H1N1抑制剂的开发
2024年5月12日,中国科学院上海药物研究所杨伟波课题组于Journal of Medicinal Chemistry发表了题为“Modular Biomimetic Strategy Enables Discovery and SAR Exploration of Oxime Macrocycles as Influenza A Virus (H1N1) Inhibitors”的研究论文。该研究发展了仿生模块化策略,为新型大环骨架在抗病毒以及其他领域的应用提供了参考。
流感病毒为RNA病毒,属于正黏液病毒科,主要分为甲(A)、乙(B)、丙(C)、丁(D)四种类型,其中甲型流感病毒最常见。目前小分子类抗甲型流感病毒药物主要分为四类(图1A):离子通道M2抑制剂、神经氨酸酶NA抑制剂、血凝素HA抑制剂和RNA依赖性RNA聚合酶RdRp抑制剂。然而,药物数量的有限性和日趋严重的耐药性是该类药物所面临的巨大挑战。此外,基因突变和重配株不断更新所导致的免疫逃逸,也使疫苗效力显著降低。因此,新型、克服耐药性的小分子抗甲型流感病毒药物的研发显得尤为迫切。
大环化合物由于具有独特的空间结构和理化性质,而逐渐成为药物研发的热点领域。杨伟波课题组长期致力于利用仿生模块化策略构建大环化合物的研究(Chem 2023, 9 (3), 607-623.; Angew. Chem. Int. Ed. 2023, 62 (15), e202218886.; Nat. Commun. 2020, 11, 2151.; J. Am. Chem. Soc. 2020, 142, 9982.; Nat. Commun. 2021, 12, 1304.; Chin. Chem. Lett. 2022, 33, 2015; Cell Chem. Biol. 2022, 29, 1126; J. Med. Chem. 2023, 66 (4), 2550)。2023年,团队通过铑催化的双碳氢键活化反应构建大环肟骨架,发现了具有抗H1N1活性的全新骨架化合物1(图1B)。
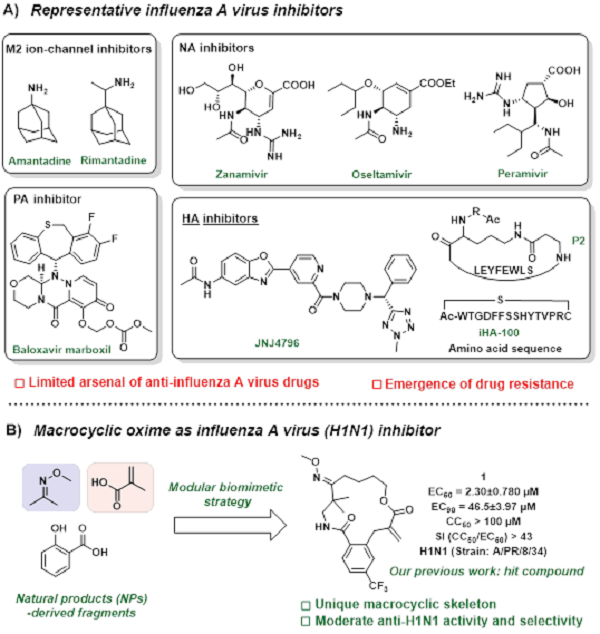
图1. 已报道的代表性甲型流感病毒抑制剂
在本项研究中,基于模块化仿生合成策略,该团队以1为先导化合物,进行抗H1N1新结构骨架和作用靶标的探索。系统的构效关系研究发现,特定的大环骨架对于维持抗H1N1的活性至关重要,最终得到了细胞水平达纳摩尔级的高活性化合物37(图2)。相比于化合物1,化合物37的EC50值提高100倍,EC90值提高300倍,且安全性更高(SI > 4347)。化合物37可有效改善H1N1的致细胞病变效应;假病毒实验初步揭示了其可能作用于HA靶点;化合物37与NA抑制剂oseltamivir联用,具有显著的协同作用。
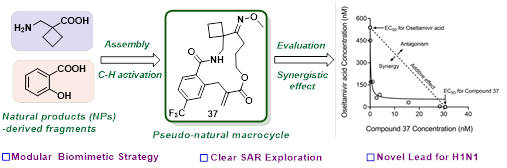
图2. 仿生模块化策略助力纳摩尔级高活性的大环肟类H1N1抑制剂的发现
上海药物所杨伟波研究员、杨莉副研究员和黄蔚研究员为论文通讯作者,左建平研究员对本项工作给予了大力支持。该研究项目得到了国家自然科学基金委、上海市科委、杭州市创新创业领导团队和中国博士后科学基金会等项目的资助。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00319
(供稿部门:杨伟波课题组)







































































































































































































































