JACS封面 | 上海药物所合作构建超声响应型脂质纳米颗粒平台,增强mRNA肿瘤疫苗治疗
2025年8月25日,中国科学院上海药物研究所于海军课题组在Journal of the American Chemical Society上发表了题为“Ultrasound-Activatable Lipid Nanoplatform for Region-Confined Innate Immune Stimulation and mRNA Vaccination Therapy of Cancer”的研究论文并入选封面论文,该研究创新性地构建了超声响应型脂质纳米颗粒平台,其在超声刺激条件下能够时空可控地调节淋巴结内先天免疫反应激活。同时,纳米平台可普适性高效递送肿瘤抗原编码线性mRNA或环状mRNA,并在体内诱导强烈且特异的抗肿瘤免疫应答。这项研究成果展示了刺激响应型免疫佐剂策略用于增强mRNA肿瘤疫苗治疗的前景。
肿瘤疫苗是一种可诱导机体特异性且持久性抗肿瘤免疫应答的治疗手段,有望改善临床肿瘤治疗现状。其中,基于脂质纳米颗粒(LNP)递送的mRNA 肿瘤疫苗作为免疫治疗的前沿技术,已有多款针对肿瘤新抗原的mRNA 疫苗进入临床研究。mRNA体外合成时通常采用核苷化学修饰策略(如甲基化假尿苷、5-甲基胞苷)以提高其转染能力和体内稳定性。然而,该策略也会显著降低mRNA编码肿瘤抗原的免疫原性,阻碍树突细胞(DC)熟化与抗原交叉呈递,限制抗原特异性T细胞免疫反应。在前期工作中,于海军课题组将一系列先天免疫信号通路激动剂,如Toll样受体(TLR)激动剂、干扰素刺激因子(STING)激动剂等有效整合至纳米疫苗递送系统中,以刺激淋巴结内DC细胞熟化,促进抗原交叉呈递与肿瘤特异性T细胞激活(Adv Mater 2022,2209910; Adv Healthcare Mater 2023, 2300524; Nat Commun 2025,16:5773)。以上研究成果表明通过设计高效且精准的免疫佐剂策略,以提高淋巴结内先天免疫反应激活的有效性与可控性,并规避非靶器官内免疫激活,对于改善mRNA 肿瘤疫苗治疗具有重要的研究价值和科学意义。
本研究中,科研人员率先开发了一类声敏剂偶联型脂质—声佐剂脂质,其在超声刺激条件下能够精准产生声动力效应以诱导DC细胞熟化与先天免疫反应激活,即具有超声响应型免疫佐剂活性。随后,研究人员通过微流控装置快速制备包载有线性mRNA的超声响应型脂质纳米颗粒(ULNP)。相比传统TLR激动剂整合的LNP(LNP@CpG),ULNP在联合超声刺激后(ULNP + US)能够有效提高淋巴结内先天免疫反应的激活水平,促进DC细胞I型干扰素分泌与抗原交叉呈递,诱导约2.5倍增加的抗原特异性CD8+ T细胞反应,并显著抑制小鼠黑色素瘤生长。此外,该超声响应型免疫佐剂策略进一步用于增强环状RNA肿瘤疫苗治疗。包载有肝癌新抗原编码环状RNA的ULNP与超声刺激联合治疗时,能够诱导强烈且安全的新抗原特异性抗肿瘤免疫应答,有效消除小鼠原位肝癌移植瘤。总的来说,声佐剂脂质工程化的超声激活型ULNP为实现时空可控的先天免疫刺激和mRNA肿瘤疫苗治疗提供了强有力的临床转化平台。
上海药物所陈方敏博士为论文第一作者,上海药物所于海军研究员和华东师范大学徐志爱教授为本文共同通讯作者。福建医科大学刘小龙教授、哈佛大学医学院陶伟教授、德国亚琛工业大学Twan Lammers教授对本课题给予了大力支持。该研究得到了国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、上海市科学技术委员会、国家博士后基金和生命过程小分子调控全国重点实验室等项目资助。生物效应评价部分得到了张江实验室国家蛋白质科学研究(上海)设施的大力支持。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.5c06028
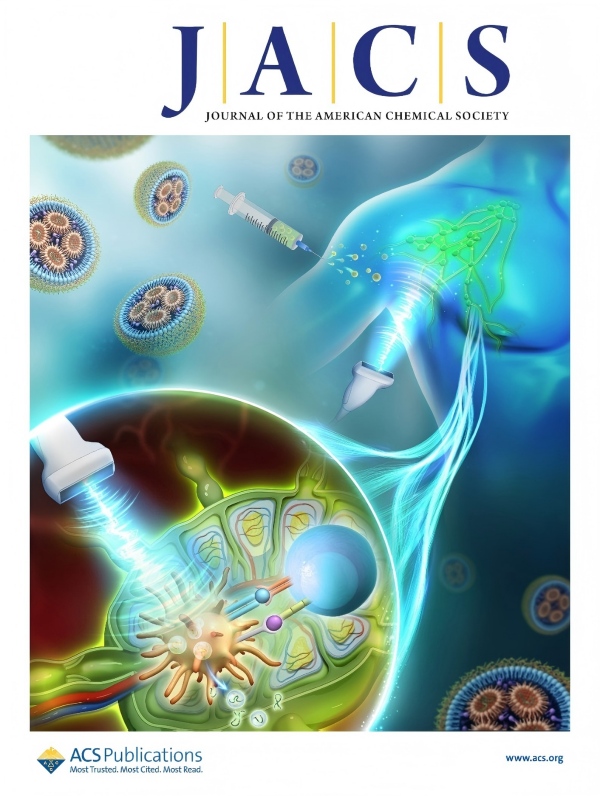
图1 超声响应型脂质纳米颗粒增强mRNA肿瘤疫苗治疗示意图(入选JACS封面)
(供稿部门:于海军课题组)







































































































































































































































