Neuron|上海药物所合作开发溶酶体TMEM175离子通道新分子,为帕金森病治疗带来新希望
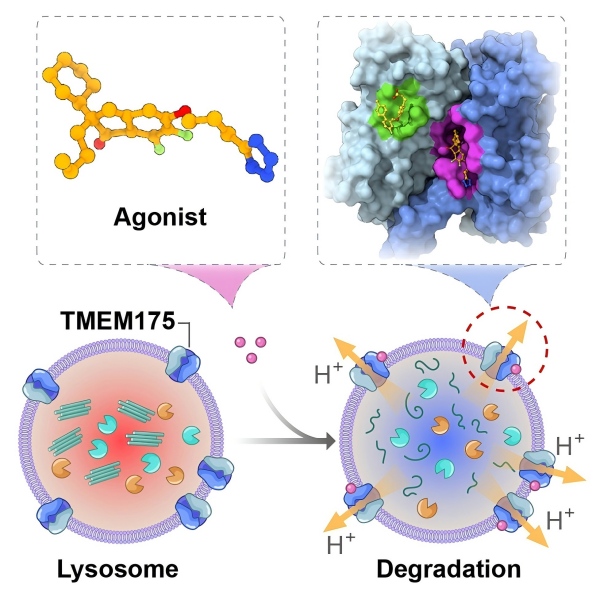
近日,中国科学院上海药物研究所周宇研究员与中科中山药物创新研究院李平研究员、尹万超研究员,上海交通大学程曦研究员,中南大学湘雅医院唐北沙教授等团队合作,通过针对性的化合物结构改造,获得DCY1020等多个活性更优的新化合物,并首次解析出多个激活剂分子与溶酶体TMEM175氢离子通道蛋白的复合物冷冻电镜结构,系统阐明了该类激活剂调控TMEM175氢离子通道的分子机制,并验证了TMEM175激活剂对PD个性化治疗潜力。相关成果于2025年8月26日,以“Structural insights into the activation of TMEM175 by small molecule”为题在线发表于《Neuron》期刊。
研究团队基于前期研究发现的TMEM175小分子激活剂先导化合物,通过初步结构优化和构效关系研究,开发出DCY1020等多个高活性的TMEM175激动剂,并成功解析出DCY1020-TMEM175复合物冷冻电镜结构,再结合位点特异性点突变、溶酶体膜片钳记录等技术,精确阐明了激活剂DCY1020调控TMEM175氢离子通道的结构基础和分子机制。基于DCY1020-TMEM175蛋白调控模式,研究团队进一步运用AI赋能的药物设计策略开展了深入的化学结构修饰与优化工作,获得了活性更优的小分子激活剂DCY1040,并同步发现DCY1040协同激活剂分子TUG-891,解析出DCY1040-TUG-891-TMEM175复合物冷冻电镜结构,清晰观察到同一个TMEM175通道蛋白内同时结合了两个小分子化合物,TUG-891位于另一个全新的结合口袋。经分子动力学模拟及溶酶体膜片钳实验,阐明了DCY1040和TUG-891分子动态调控TMEM175通道构象变化的分子机制。
研究团队进一步通过细胞和动物疾病模型,评估了TMEM175激活剂分子改善PD的药效。在神经元疾病模型中,DCY1040和TUG-891小分子显著促进了细胞对a-突触核蛋白聚集体的清除效率。在斑马鱼疾病模型中,a-突触核蛋白的溶酶体清除过程能够被DCY1040和TUG-891小分子加速,其相关的运动行为学障碍也得到了显著改善。上述药效学结果初步验证了靶向溶酶体TMEM175氢离子通道有望开发出PD治疗药物。
通过中南大学湘雅医院唐北沙教授团队合作,该研究还探索了我国PD患者TMEM175多个临床突变体,发现多个临床突变与TMEM175离子通道功能下调密切相关。深入研究发现,DCY1040等化合物可显著恢复多个功能下调型临床变异的通道功能。特别的是,在携带TMEM175临床变异的多种帕金森病患临床样本上,DCY1040和TUG-891均表现出调控溶酶体酸化的能力,为未来PD个性化治疗药物开发打下了坚实的基础。
总体而言,该研究初步完成了靶向溶酶体氢离子通道TMEM175的抗PD药物研发概念验证工作,为未来PD对因治疗药物的开发和个性化治疗奠定了基础。
中科中山药物创新研究院李平研究员、上海药物所周宇研究员、中科中山药物创新研究院尹万超研究员、上海交通大学程曦研究员、中南大学湘雅医院唐北沙教授为本文共同通讯作者。中科中山药物创新研究院朱学武博士、平美萱,上海药物所刘恒博士、喻婷、侯鑫娇,中南大学湘雅医院刘振华教授,南京中医大学江忠文,南方医科大学黎婵婧为本文共同第一作者。该研究得到了浙江大学徐浩新教授、胡美钦教授的悉心指导,以及上海药物所高峰电镜中心的支持。
原文链接:https://doi.org/10.1016/j.neuron.2025.07.029
溶酶体TMEM175离子通道新分子
(供稿部门:李平课题组、周宇课题组)







































































































































































































































