PNAS | 上海药物所解析生长抑素受体5与天然肽和药物分子的激活机理
生长抑素受体(Somatostatin receptors,SSTRs)是一类重要的G蛋白偶联受体(GPCRs),在调控多种激素分泌和抑制肿瘤生长等方面发挥关键作用,是治疗肢端肥大症、垂体腺瘤、神经内分泌肿瘤等疾病的重要靶点。SSTR5共有五种亚型(SSTR1-SSTR5),其中,SSTR5在垂体中高度表达,调控促肾上腺皮质激素、催乳素和生长激素等激素分泌,是相关内分泌疾病和肿瘤治疗的潜在靶点。
生长抑素(Somatostatin,SST)是SSTRs的天然配体,具有抑制生长激素、胰岛素、胰高血糖素等多种激素分泌的作用。SST通过与SSTRs结合,抑制腺苷酸环化酶(Adenylate Cyclase,AC)的活性,主要由抑制性G蛋白(Gi)介导,进而调控胞内cAMP浓度,将外源信号传递至胞内(图1A),影响多种激素的分泌和肿瘤的生长等过程。皮质抑素(Cortistatin,CST)是一种与所有SSTRs亚型亲和力很高的神经肽,与SST具有高度的结构同源性,CST在人体内发挥相同的SST内分泌活性,另外还具有抗炎症和抑制血管内皮细胞增殖作用,近年来多项研究相继揭示SST作用不同的SSTR2和SSTR4的分子机制,CST识别和调控SSTRs的作用机制尚不明确。
CST17在大脑皮层中表达水平较高,与SST14具有相同的半胱氨酸环状结构及与SSTR结合序列Phe-Trp-Lys-Thr (FWKT)(图2A-B),均能激活SSTR5,但其详细的激活机制仍未知。由于SST在血浆中的半衰期短,限制了其临床应用。FDA批准的生长抑素激动剂合成药物奥曲肽(octreotide)不仅对SSTR2具有较高亲和力,同时也能有效激活SSTR5,目前已用于治疗肢端肥大症和神经内分泌肿瘤等疾病。
尽管多种靶向SSTRs的SST类似物已经被开发出来用于临床。但由于SSTR亚型之间序列高度同源,开发出能够高选择性调控特定亚型并最大限度减少非靶向效应的药物仍然是一大挑战。SSTR5作为重要的药物靶点,阐明其与配体识别和激活的分子机制,对指导设计新型高选择性SSTR5激动剂具有重要意义。
2024年06月18日,中国科学院上海药物研究所徐华强/赵丽华团队在《美国科学院院刊》(PNAS)在线发表了以"Structural basis for activation of somatostatin receptor 5 by cyclic neuropeptide agonists"为题的研究论文。该研究利用冷冻电子显微镜技术,首次解析了天然多肽激动剂CST17和临床抗肿瘤药物octreotide分别激活SSTR5并结合下游Gi蛋白的三维复合物结构,分辨率分别为2.7和2.9埃(图1B-G)。
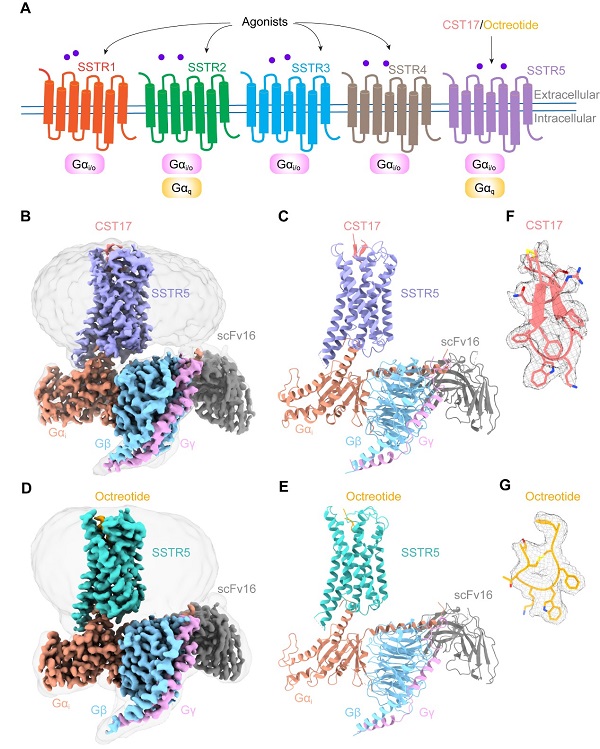
图1 (A) 激动剂介导的SSTRs的G蛋白信号传导通路示意图。(B-C) CST17-SSTR5-Gi复合物冷冻电镜结构。(D-E) Octreotide-SSTR5-Gi复合物冷冻电镜结构。(F) CST17在结构中的密度图。(F) Octreotide在结构中的密度图。
该项研究发现,CST17和octreotide的结合会引起SSTR5中由TM3和TM6组成的"疏水锁"重排,并导致TM6向外运动,从而使Gαi蛋白与受体结合并启动下游信号传导(图2C-D)。结构和功能分析显示,SSTR5细胞外环坏区ECL2和ECL3对CST17和octreotide具有不同的识别模式(图2E-F),解释了它们作为激动剂的选择性差异,阐明了SSTR5的激活机制和与肽激动剂识别的分子基础,为针对SSTR5开发新型高选择性,低副作用的药物治疗肢端肥大症、神经内分泌肿瘤等相关疾病提供结构基础。
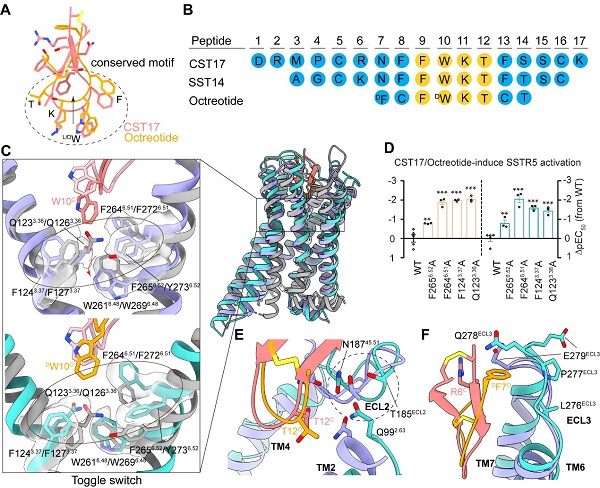
图2(A-B)内源肽和octreotide的结构和序列比对。(C) SSTR5中的"疏水锁"在结合激动剂后发生了构象重排。(D)功能数据验证关键氨基酸对CST17和octreotide激活SSTR5的影响。(E)两种复合物结构中ECL2构象的差异。(F)两种复合物结构中ECL3构象的差异。
本研究中的冷冻电镜数据由上海药物所高峰电镜中心收集。南京中医药大学硕士研究生李静茹、上海药物所游宠昭博士和硕士研究生李阳为该论文的共同第一作者。上海药物所赵丽华研究员、徐华强研究员为论文的共同通讯作者。该项工作得到了国家自然科学基金委员会、上海市“科技创新行动计划”自然科学基金、国家重点研发计划、上海市科学技术委员会、中国科学院青年创新促进会、中国科学院战略性先导科技专项(B类)和原创新药研究全国重点实验室等项目资助。