Adv Sci | 上海药物所合作揭示结直肠癌完整N-糖基化代谢特征及临床意义
2025年4月26日,中国科学院上海药物研究所黄河课题组联合复旦大学华山医院李群益团队、华中科技大学同济医学院附属同济医院梅齐团队在Advanced Science杂志在线发表了题为“Deciphering the Metabolic Impact and Clinical Relevance of N-Glycosylation in Colorectal Cancer Through Comprehensive Glycoproteomic Profiling”的研究论文。该研究通过系统性的N-糖基化蛋白质组学分析,揭示了结直肠癌(CRC)中N-糖基化修饰的代谢调控特征及其临床相关性,为CRC的诊断、预后评估和靶向治疗提供了新的见解和潜在干预靶点。
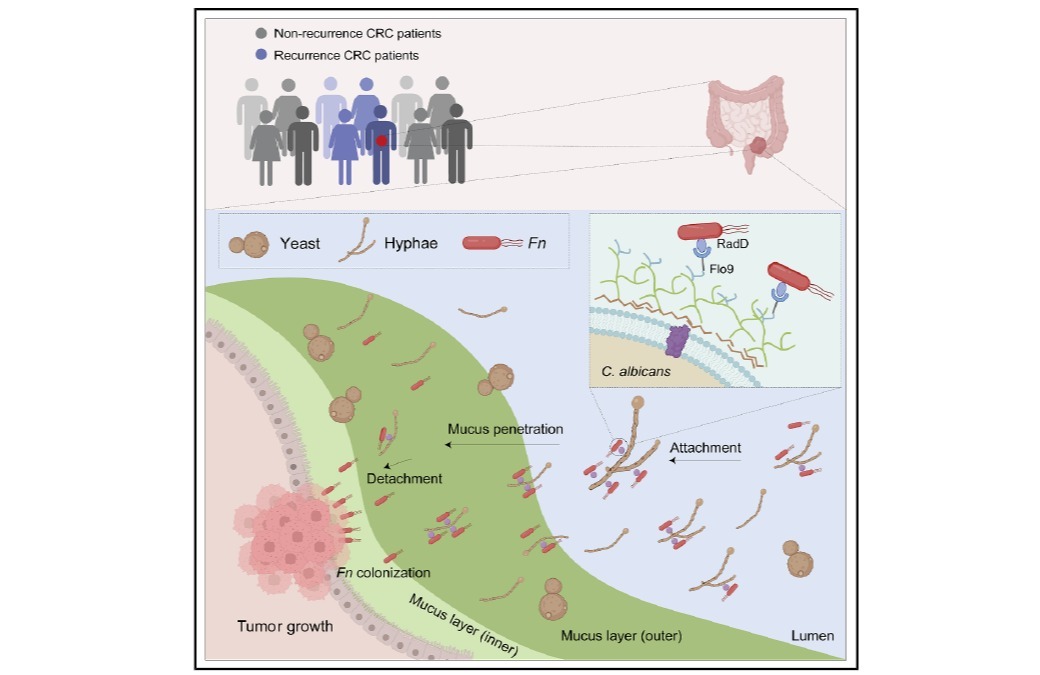
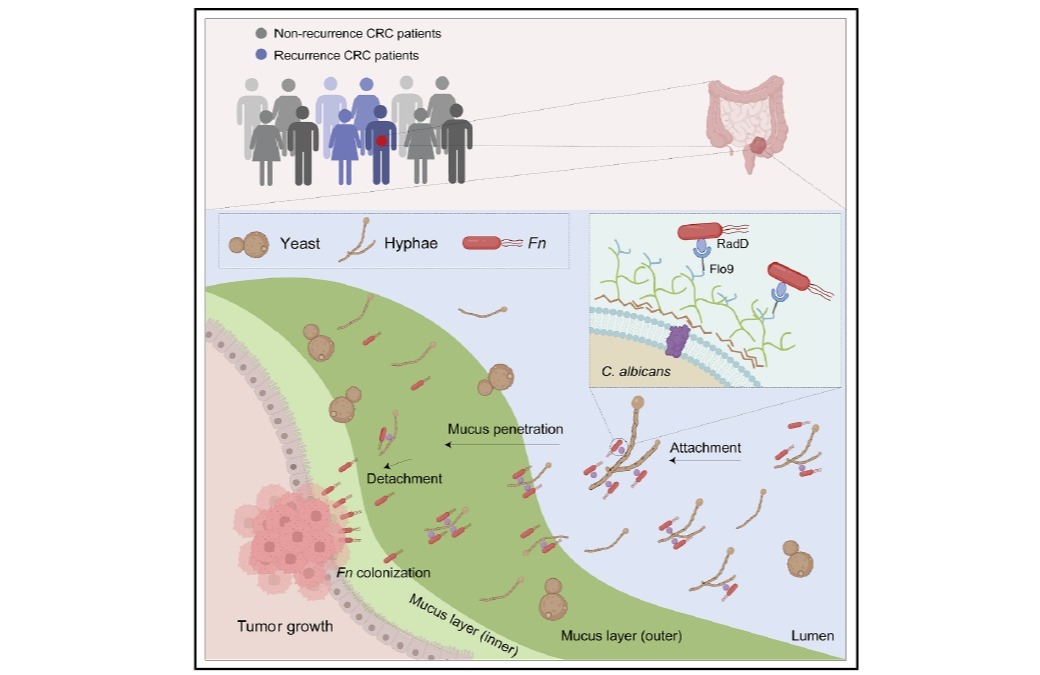
CRC是全球常见的恶性肿瘤之一,其发生发展与代谢改变密切相关,其中N-糖基化的失调在CRC进程中发挥关键作用。糖基化修饰是糖链在糖基转移酶的作用下与某些氨基酸侧链上的活性基团反应生成糖苷键,从而使多糖共价结合在蛋白上,是最常见和最复杂的蛋白翻译后修饰之一。现已有研究表明,在CRC的发生发展、转移和侵袭过程中,蛋白糖基化修饰水平发生显著变化。根据糖链与氨基酸生成糖苷键的不同,糖基化修饰可分为O-糖基化和N-糖基化。N-糖基化修饰在蛋白折叠、稳定、蛋白运输、细胞-细胞间相互作用、细胞分化以及免疫反应等多种生物学过程中发挥着重要作用。并且N-糖基化异常与肿瘤发生发展、恶性转化、转移和侵袭等密切相关。因此,阐明N-糖基化修饰驱动CRC发生发展的潜在分子机制,鉴定新的药物靶点,对CRC的药物开发以及临床治疗具有重要意义。然而,目前对CRC中N-糖基化的代谢调控机制及功能意义仍缺乏系统认知。
本研究对45例CRC组织及其配对癌旁正常组织(NATs)进行了全面的蛋白质组学和N-糖基化完整糖肽(IGPs)分析,共鉴定出7125种IGPs,对应于704种糖蛋白。通过分析IGPs表达谱和结构特征,构建了糖型-糖基化位点-蛋白功能多维关联网络,系统揭示了N-糖基化介导的CRC中功能失调图谱。此外,研究团队开发了一种整合不同糖型丰度差异表达的算术模型,不仅可准确区分肿瘤和正常组织,还揭示了CRC特异的代谢重编程特征。进一步研究发现,联合CLCA1和OLFM4是CRC诊断的潜在生物标志物,并通过免疫组化和Cox 回归分析验证了其预后价值。特别值得注意的是,本研究揭示了脂肪细胞质膜相关蛋白(APMAP)N196位点的特定N-糖基化在CRC进展中的关键作用,为靶向干预提供了潜在靶点。这些发现为深入理解CRC中N-糖基化的代谢作用提供了新见解,推动了生物标志物的发现,提高了基于代谢的诊断精度,并改善了针对癌症代谢的个性化治疗策略。
上海药物所研究助理刘国斌、复旦大学华山医院陈璐为本文共同第一作者。上海药物所黄河研究员、复旦大学华山医院李群益主任和华中科技大学同济医学院附属同济医院梅齐主任为共同通讯作者。该项工作得到了上海市糖专项、国家自然科学基金、中国科学院战略性先导科技专项、上海市自然科学基金和山东省实验室项目等项目的支持。
全文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202415645
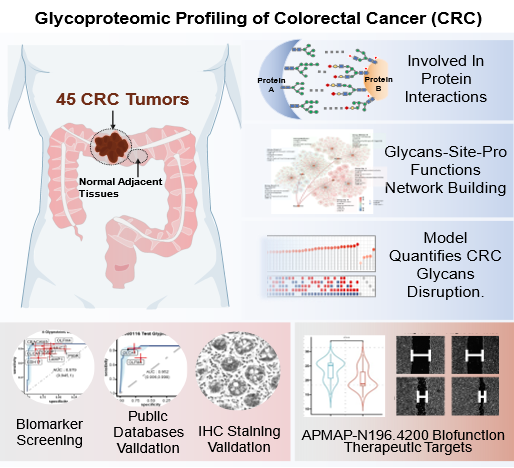
糖基化修饰调控结直肠癌发生和进展
(供稿部门:黄河课题组)