Nature | 上海药物所联合破解去甲肾上腺素转运体二聚化和抗抑郁药分子识别密码
2024年5月15日,Nature杂志在线发表了题为“Dimerization and antidepressant recognition at noradrenaline transporter”的研究论文,该研究成果由中国科学院上海药物研究所徐华强课题组、杨德华课题组和临港实验室蒋轶课题组合作完成。该研究破解了重要神经系统疾病靶标——去甲肾上腺素转运体(noradrenaline/norepinephrine transporter,NET)同源二聚化,转运天然底物去甲肾上腺素NE,以及选择性识别六种抗抑郁药物的分子密码,为理解NET等单胺类转运体的生理调控机制奠定了重要的理论基础,也对指导靶向单胺类转运体(monoamine transporters,MATs)的抗抑郁症等神经精神类疾病的药物研发具有重要的现实意义。特别值得注意的是,该研究首次在近原子分辨率上发现了由胆固醇和脂质介导的膜蛋白同源二聚体形成机制,为细胞膜“脂筏模型”提供了眼见为实的依据。

NET属于MATs家族,与同家族的血清素转运体(serotonin transporter, SERT)和多巴胺转运体(dopamine transporter, DAT)共同调控神经突触神经递质的浓度,维持体内神经递质的平衡。MATs是精神刺激剂和抗抑郁药物的主要靶点。在过去的近70年,MATs与抑郁症病理学的关联从药理学、遗传学、分子生物学和临床研究等多个角度被证实,单胺假说也曾主导了近几十年抗抑郁药物的研发。血清素和去甲肾上腺素双重再摄取抑制剂(SNRIs)与选择性血清素再摄取抑制剂(SSRI)作为一线药物用于抑郁症的临床治疗,选择性去甲肾上腺素再摄取抑制剂(NRIs)和三重再摄取抑制剂(TRIs)也已获批用于抑郁症的治疗。此外,NET的功能异常也与注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)等神经精神类疾病密切相关。
MATs的功能受胆固醇和脂质介导的寡聚化调控。早期研究表明,NET和SERT均与脑组织和转染细胞系中富含胆固醇的区域相关。磷脂酰肌醇4,5-双磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2)促进NET二聚化并调节底物的外流。胆固醇和PIP2参与SERT的功能调控,PIP2的直接结合介导了SERT寡聚体的形成。PIP2也以寡聚体依赖的方式,在苯丙胺诱导的血清素外排中发挥重要的调节作用。然而,当前有限的结构信息导致科学界对NET与底物和抗抑郁药物的精准结合模式,抗抑郁药物对三种MAT亚型的选择性识别机制,以及胆固醇和脂质调节NET功能及其寡聚化过程的精确机制仍然缺乏深入的理解。

图1. 人源NET二聚体分别与底物和六种抗抑郁药物复合物的代表性结构
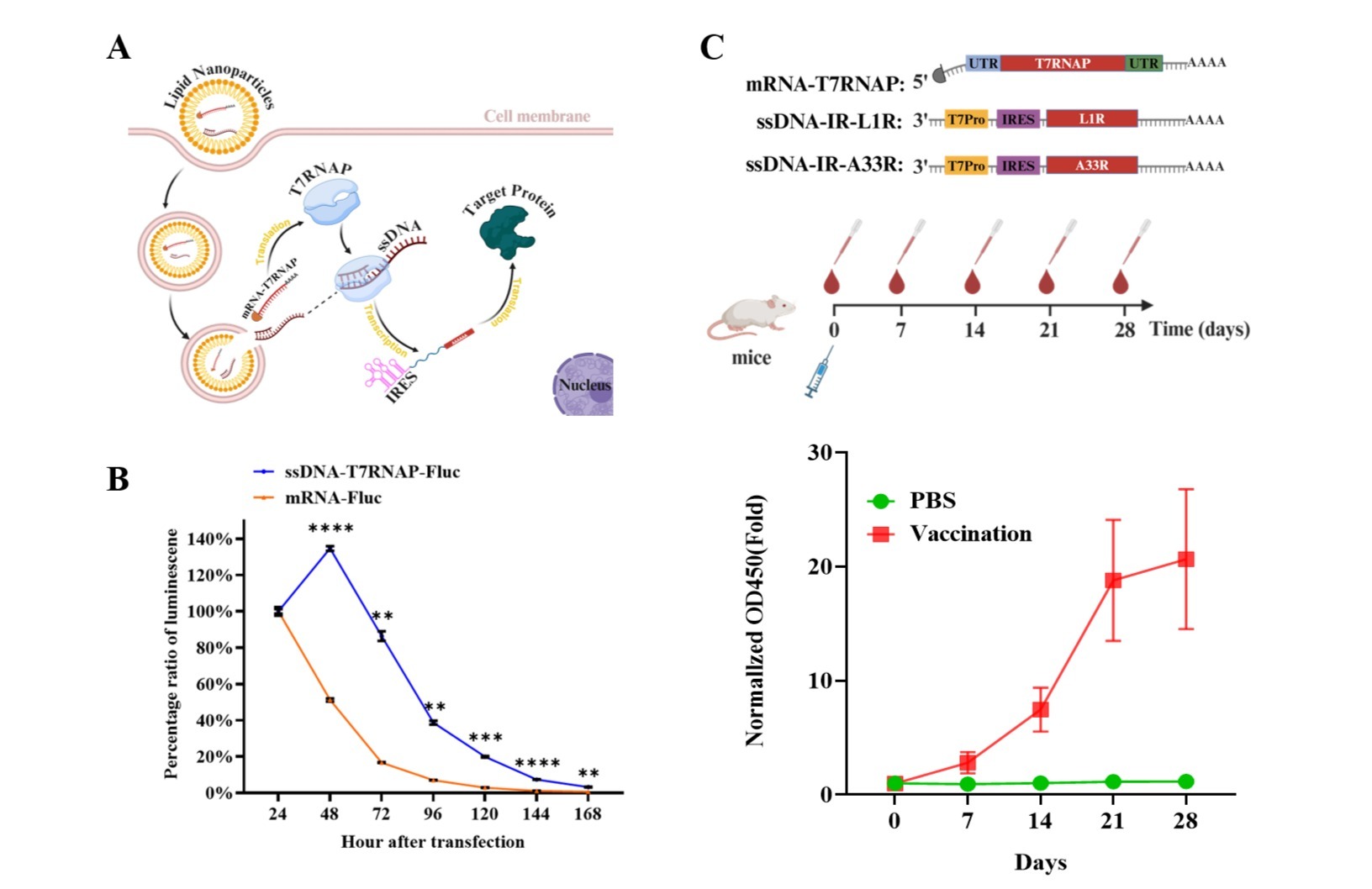
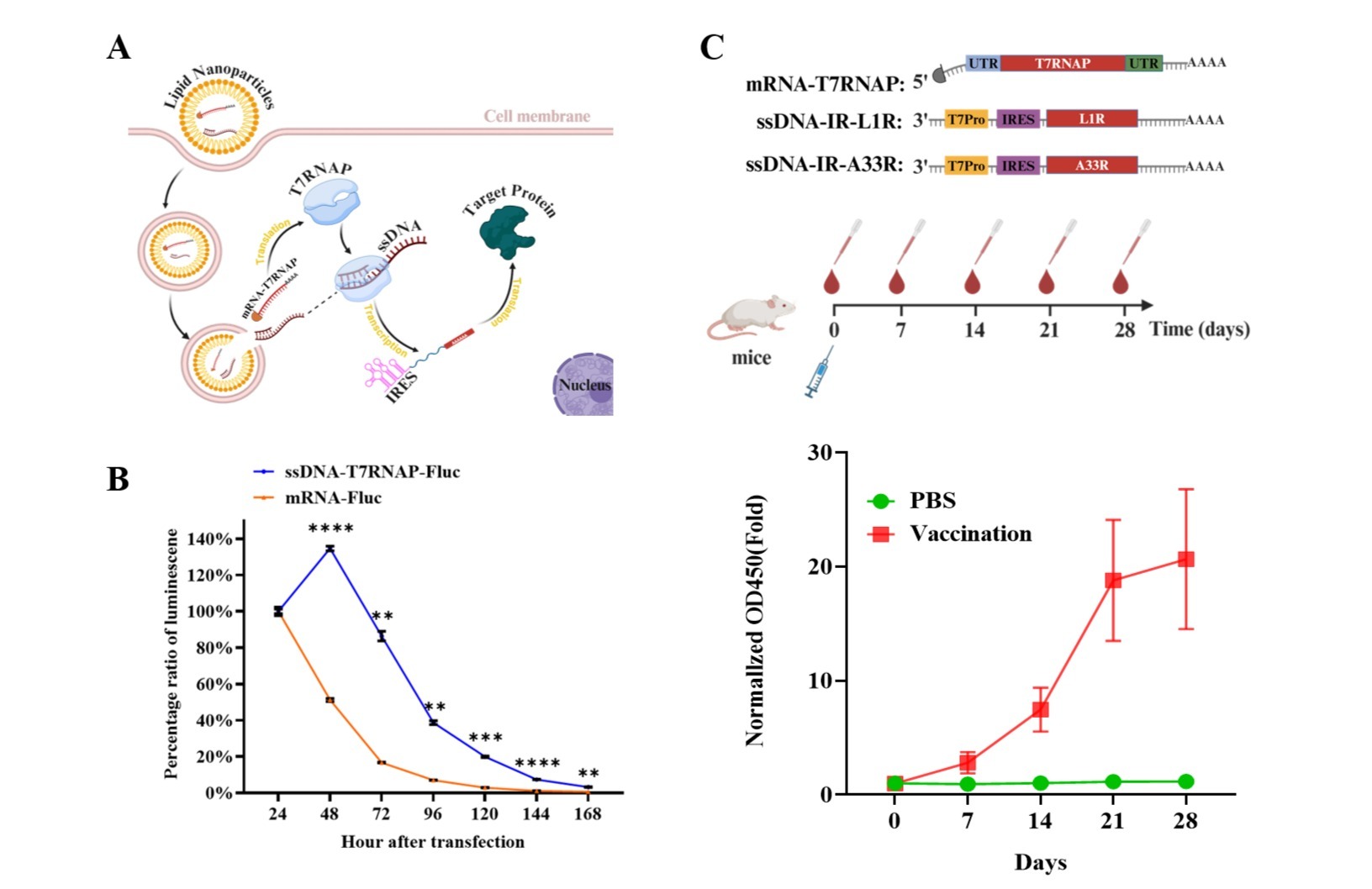
本项研究中,联合团队利用单颗粒冷冻电镜技术,获得了人源NET同源二聚体分别与底物NE结合的阻塞构象、无底物结合的apo状态,以及六种抗抑郁药物(尼索西汀、阿米替林、马普替林、诺米芬辛、托莫西汀和奈福泮)的外向开放构象的8个高分辨率结构,分辨率达到2.9-3.4 埃(图1)。

蝴蝶兰象征 NET 同源二聚体,白色花瓣暗指 NET单体。中间的黄色唇瓣代替胆固醇和脂质分子。落在花朵上的蝴蝶象征选择性靶向药物,蝴蝶翅膀装饰着抗抑郁药物的化学结构。(Zihao Li设计,蝴蝶意象由崔娜娜提供)
研究显示,NET呈现由胆固醇和脂质分子介导的独特二聚体构型(AlphaFold目前还无法预测此二聚体构型)如科学插图中蝴蝶兰两片花瓣的形态。胆固醇和脂质分子被包夹在NET单体之间,构成了NET同源二聚体的主要作用界面,如科学插图中蝴蝶兰花蕊示意的位置。这与其他膜蛋白通过蛋白-蛋白直接相互作用组装为寡聚体的方式截然不同。进一步生化细胞实验证实,胆固醇和脂质介导的二聚化贡献于NET的转运功能(图2)。如科学插图中不同小分子纹饰的蝴蝶在蝴蝶兰上的停留状态,该研究提出了不同MAT选择谱的六种抗抑郁药物与NET的选择性。

图2. 胆固醇和脂质调控NET同源二聚化和转运活性
综上,这些研究结果回答了胆固醇和脂质调控NET等MAT寡聚化及其转运功能,以及NET底物识别和转运调节等基础生物学问题,破解了抗抑郁药物选择性靶向NET的分子密码。这些成果加深了对NET的结构和功能的理解,同时为抗抑郁药物治疗提供了重要的结构基础和药物设计参考。
本研究的冷冻电镜数据在上海市高峰电镜中心收集。上海药物所博士后张衡、助理研究员代安涛和临港实验室博士后殷裕玲为该论文的共同第一作者。临港实验室研究员蒋轶、上海药物所研究员徐华强、杨德华为该论文的共同通讯作者。该成果获得了科技部、基金委和上海市等项目的支持。
全文链接: https://www.nature.com/articles/s41586-024-07437-6
徐华强团队长期致力于神经递质受体的结构与功能研究,并取得了系统性的重要成果。
2013年,该团队在Science上首次报导了激动剂结合的5-羟色胺受体5-HT1B的高分辨率晶体结构,该论文第一作者蒋轶(现临港实验室独立研究员)为此篇去甲肾上腺素转运体文章的通讯作者。
2021年02月,该团队在Cell(Cover)揭示了多巴胺受体D1R和D2R配体结合口袋的拓扑结构特性、潜在的受体激活机制、配体激动剂选择性识别并激活D1R和D2R的分子机制、D1R的G蛋白偏好性激活决定因素以及D1R和D2R在G蛋白选择性差异上的结构基础等。
2021年03月,该团队在Nature上首次报道了5-HT1A、5-HT1D、5-HT1E受体的结构,并揭示了磷脂PI4P(PtdIns4P)和胆固醇调节受体功能的机制和受体的本底激活机制。
2022年11月,该团队在Cell(Best of Cell 2023)上报道了芬太尼、吗啡及Oliceridine等阿片类镇痛药物分别激活μ型阿片受体(μOR)的高分辨率三维结构,首次揭示了芬太尼和吗啡识别并激活μOR的作用机制。
2023年01月,该团队在Cell上系统地分析和明确了各内源性阿片肽对阿片受体的信号活性,揭示了多肽类配体和阿片受体的结合模式,阐述了它们的选择性和保守性机制,为“信使-信箱-效能”模式提供了结构和功能支持。
2023年11月,该团队与徐菲课题组等合作在Nature上揭示“冰毒”与其受体TAAR1的分子识别机制,代表了冰毒-多巴胺成瘾研究领域的一项重大进展。