Adv Mater | 工程化树突状细胞递药系统调控肠道免疫应答治疗炎症性疾病
肠道免疫稳态对宿主预防多种疾病至关重要。肠道免疫稳态被破坏可能导致严重的炎症性疾病,如炎症性肠病(IBD)等。虽然IBD致病机制复杂,但肠道炎症是其重要的病理特征,抑制炎症反应是治疗IBD的重要手段。尽管现有治疗策略如小分子JAK抑制剂、靶向TNF的生物制剂、白细胞介素抑制剂乃至干细胞疗法等在部分患者中取得了显著疗效,但仍需要开发新策略来解决患者常出现的原发或继发耐药问题。
2025年6月22日,中国科学院上海药物研究所李亚平团队与上海交通大学王当歌团队合作在Advanced Materials上发表了工程化树突状细胞(DCs)递药系统调控肠道免疫应答治疗炎症性疾病研究成果“Dendritic Cell-Based Biohybrid Immunomodulator Alleviates Intestinal Inflammatory Disease”。该研究设计了一种基于树突状细胞(DC)的免疫调节剂(FasL-DC-Lipo),通过调节IBD病灶免疫微环境缓解肠道炎症反应。通过基因工程和生物正交化学技术构建了工程化DCs递药系统,发现在腹腔注射后可定向迁移至肠道组织,有效诱导中性粒细胞和活化T细胞的凋亡,减少IBD病灶促炎症免疫细胞比例,在小鼠和兔IBD模型中均表现出良好的治疗效果。该研究提出了一种可个性化定制的减轻肠道炎症反应的新策略,为IBD的治疗提供了新思路。
该研究基于对IBD患者病灶样本的蛋白质组学分析,确定了IBD组织具有T细胞高浸润和Fas高表达等关键分子特征。针对上述分子特征,通过基因工程技术制备了过表达Fas配体(FasL)的DCs,并通过生物正交化学偶联封装消退素E1(RvE-1)的脂质体,获得工程化DCs。结果显示:(1)经腹腔注射后,通过血管途径由肠系膜定向迁移并浸润肠道组织,提高RvE-1的肠道靶向分布;(2)通过Fas/FasL信号和释放的RvE-1引发Fas+CD8+ T细胞和中性粒细胞的凋亡,从而抑制肠道炎症反应;(3)肠炎部位免疫细胞重编程为抗炎表型,抗炎细胞因子含量升高,显著抑制小鼠和兔模型中IBD的进展。人源化生物杂合DC系统的构建及初步概念验证发现其有良好的临床转化潜力,有望为动态调节肠道疾病进展中的免疫稳态提供安全可行的个性化治疗平台。
上海药物所李亚平研究员和上海交通大学王当歌研究员为本文的共同通讯作者,上海药物所博士生易文哲、上海交通大学孙芳博士为本文共同第一作者。该研究得到了科技部重点研发计划、国家自然科学基金、上海市科学技术委员会和烟台新药创制山东省实验室等项目的资助。
全文链接:https://doi.org/10.1002/adma.202420113
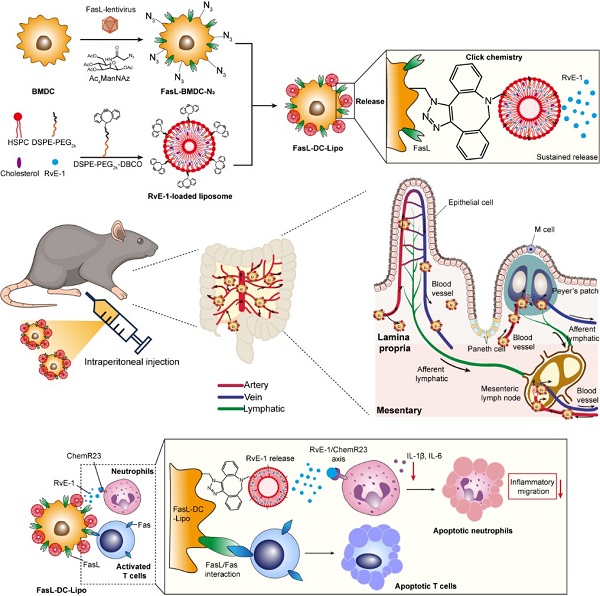
图 工程化树突状细胞递药系统的构建和作用机制
(供稿部门:李亚平课题组;供稿人:易文哲)







































































































































































































































