Cell Reports|上海药物所解析亲吻素受体配体识别与下游G蛋白招募机制
1996年,kisspeptin在宾夕法尼亚州的Hershey市被发现,并以著名的“Hershey's Kisses”巧克力的名字命名。这种神经肽原本被称为“metastin”,因为它具有抑制肿瘤转移的能力。然而,当人们发现kisspeptin通过与其受体KISS1R结合并激活来发挥作用时,它的生理重要性才真正显现出来。KISS1R信号通路迅速被认为是下丘脑-垂体-性腺轴(HPG)的最重要的上游调节因素 (图1)。
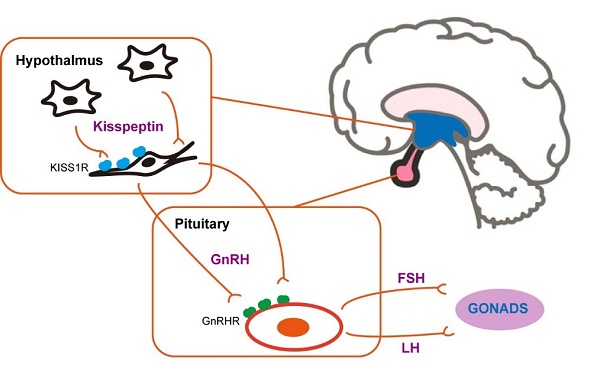
图1. 位于下丘脑-垂体-性腺轴(HPG)的GPCR信号通路
随着对kisspeptin-KISS1R信号通路的深入研究,在生殖生理学领域,kisspeptin被发现是一种强效的促性腺激素释放激素(GnRH)分泌的刺激剂。促性腺激素释放激素(GnRH)对于正常的青春期发育和女性排卵至关重要,是哺乳动物基础生育功能的核心激素。当下丘脑中的kisspeptin表达减少或KISS1R功能异常时,会导致严重的生殖障碍,如特发性促性腺激素缺乏症(IHH)、中枢性性早熟(CPP)和多囊卵巢综合征(PCOS)。
KISS1R是一种A类G蛋白偶联受体,主要与Gq/11蛋白偶联,通过激活磷脂酶C来增加细胞内IP3和Ca2+水平。在成年大脑中,KISS1R主要分布在下丘脑,调控生殖功能。kisspeptin是由KISS1基因编码的前体蛋白,通过蛋白酶解生成多种生物活性短肽,如kisspeptin-54、kisspeptin-14等,它们通过保守的C端结构激活KISS1R。其中,kisspeptin-10(KP-10)是体内具有基础激活效力的最短长度的kisspeptin (图2)。
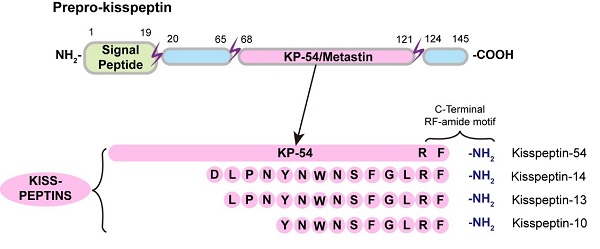
图2. 体内具有基础激活效力的不同长度的kisspeptin
研究表明,持续给予kisspeptin可以恢复LH(黄体生成素)的脉冲性分泌,这提示位于上游的KISS1R可能是治疗生殖疾病的更好靶点。KP-10的给药已被证明在动物模型中有效治疗生殖障碍,但这种内源性配体易被代谢降解。因此,开发更有效稳定的靶向KISS1R的激动剂是当前的研究重点。为了克服kisspeptin在体内的降解和快速清除问题,药物化学家们开发了TAK-448等kisspeptin-10类似物,这些化合物显示出比kisspeptin更好的生物活性和更长的作用时间 (图3)。
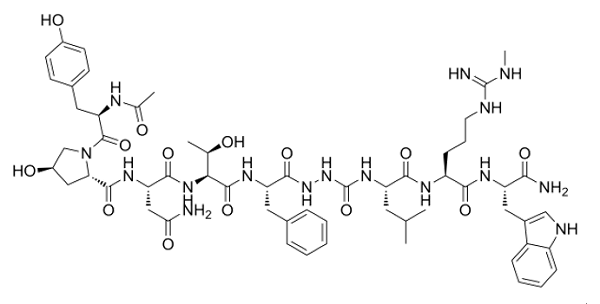
图3. TAK-448的分子式
2024年6月26日,中国科学院上海药物研究所段佳研究员团队联合徐华强研究员团队,在Cell Reports在线发表了以《Structural Basis for Hormone Recognition and Distinctive Gq Protein Coupling by the Kisspeptin Receptor》为题的研究论文。该研究首次解析了Gq偶联的KISS1R与内源性最短有效多肽KP-10和多肽类似物TAK-448的复合物结构,分辨率分别为3.06 埃和3.07 埃,揭示了多肽激动剂与KISS1R的相互作用机制,为未来基于结构的药物设计奠定了坚实基础 (图4A)。
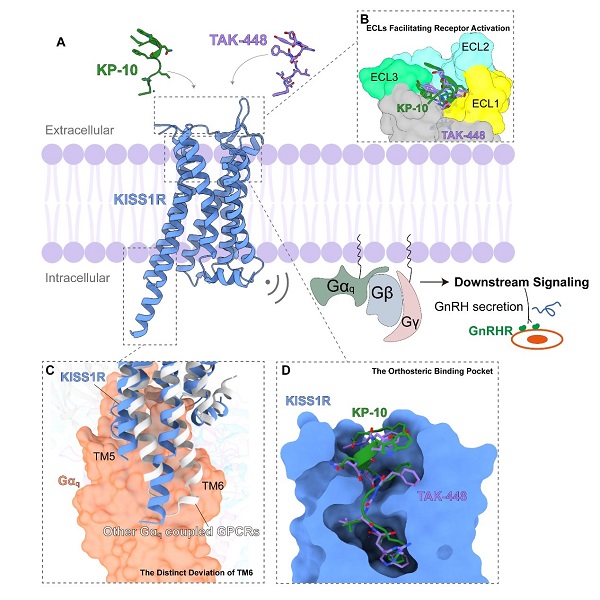
图4. 本文的主要结果和发现 (A)本文解析的KISS1R激活态结构;(B) KISS1R的外周环(ECLs)在受体激活中起着关键作用;(C) KISS1R相较其他Gq偶联的GPCR独特的TM6偏转;(D) KP-10和TAK-448在受体正构口袋的相似结合构象。
研究发现,KISS1R的外周环(ECLs)在受体激活中起着关键作用,分子动力学模拟和功能突变研究进一步证实了这一点(图4B)。研究还指出,TAK-448在激活效力上优于KP-10的原因,这为合理优化KP-10类似物提供了依据。此外,与其他Gq偶联受体相比,KISS1R的TM6区域在受体内侧展示了独特的角度偏离,这是其与Gq蛋白偶联中一个显著特征(图4C)。研究进一步强调了受体TM5-ICL3-TM6区域在下游Gq偶联中的重要性。KP-10和TAK-448在KISS1R的配体结合口袋中采用了相似的构象,它们的结合模式揭示了特定残基(如F195ECL2、N2085.43和W2766.48)对于配体识别和受体激活具有重要影响(图4D)。总体而言,本文的结构研究为理解KISS1R的肽配体识别、受体激活及其与Gq蛋白偶联的分子机制奠定了坚实基础。这些结构和功能研究结果为应对生殖和癌症治疗领域的关键挑战提供了宝贵见解。
近年来,该研究团队在性腺轴相关GPCR的结构与功能研究领域取得了一系列突破性进展,先后解析了位于性腺轴最下游的绒毛膜促性腺激素受体(LHCGR)、促卵泡激素受体FSHR处于失活状态和多种激活状态的结构(Nature 2021,Nature Communications 2023),首次提出了该类激素激活受体的“push and pull”模型,并首次揭示了小分子变构调节激动剂的作用模式及选择性识别受体的分子基础。本研究成功揭示了位于性腺轴最上游的调控受体KISS1R受多肽KP-10和TAK-448识别和调控的分子机制。相关研究为生殖系统疾病和肿瘤的药物开发提供了结构模板。
上海药物所博士生沈诗怡,中科中山药物创新研究院博士后王冬雪,上海药物所博士后刘恒及博士生何欣恒为本文的共同第一作者。上海药物所段佳研究员、徐华强研究员为共同通讯作者。上海市高峰电镜中心负责了该项研究冷冻电镜数据的收集。该工作得到中国科学院战略性先导科技计划、上海市科技重大专项、国家自然科学基金、国家重点研发计划、上海市扬帆计划、中国科学院特别研究助理等项目资助。
全文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00717-4







































































































































































































































