Nat Metab | 上海药物所合作发现高血糖刺激神经元分泌CCL2是糖尿病诱发焦虑障碍的关键机制
2025年5月6日,中国科学院上海药物研究所李佳研究员和临港实验室臧奕研究员合作,在Nature Metabolism杂志在线发表了题为“Neuronal CCL2 responds to hyperglycemia and contributes to anxiety disorders in the context of diabetes”的研究论文,报道了高血糖可通过调节中央前额叶皮层和腹侧海马的神经元CCL2及神经免疫细胞活化,从而促进糖尿病的小鼠焦虑行为。
糖尿病(Diabetes mellitus, DM)是全球范围内持续的重大健康挑战。研究表明,焦虑障碍在糖尿病人群中有较高的发生率,并损害糖尿病治疗的依从性。然而,针对糖尿病患者焦虑症的综合干预方案仍然有限,主要原因在于传统抗焦虑药物可能加重代谢问题,使患者难以从治疗中获益。因此,加深对糖尿病—焦虑共病机制的理解,将是解决问题的关键途径。长期以来,“中枢胰岛素抵抗”被认为是糖尿病患者焦虑障碍的主要诱因。然而,最新研究揭示,全脑胰岛素受体敲除小鼠模型并未出现焦虑表型。这一发现质疑了经典“中枢胰岛素抵抗”理论的可靠性;因此亟需探索新的机制,揭示糖尿病—焦虑障碍共病的发生机制。
高血糖是糖尿病的关键特征之一,糖尿病治疗的临床观察表明,使用非依赖胰岛素的降糖药物与较低的焦虑障碍风险相关,提示高血糖可能是糖尿病并发焦虑症的主要原因。然而,高血糖调控焦虑障碍的因果关系及具体机制仍不清楚。
研究发现,糖尿病和精神疾病患者的外周血液中多种趋化因子水平升高, 科研人员由此提出科学假设,是否可能由于高血糖引起特定趋化因子升高促发焦虑症发生。
糖尿病患者中焦虑障碍的高发性及其对疾病管理的不良影响已被临床研究证实,但其病理机制尚不清楚。本研究通过STZ诱导的糖尿病小鼠模型,评估其焦虑行为,并筛查焦虑相关脑区及外周组织中趋化因子的表达变化,发现CCL2在中枢神经系统和外周均显著上调。CCL2的全身敲除可有效缓解焦虑行为,表明其在糖尿病相关焦虑中的关键作用。进一步通过特异性抑制外周或中枢CCL2,发现仅抑制中枢CCL2能改善焦虑症状,而外周CCL2的抑制无效,表明糖尿病小鼠的焦虑行为主要依赖于中枢系统中的CCL2。此外,CCL2的表达主要集中在中央前额叶皮层和腹侧海马脑区,并且特异性定位于神经元。细胞实验进一步揭示,高血糖可通过激活神经元渗透压感受器TonEBP,转录上调神经元CCL2的表达,从而促进焦虑行为的发生。
在机制研究中,本研究发现CCL2通过与其受体CCR2的结合,激活神经免疫细胞,尤其是小胶质细胞和外周入侵的单核细胞,诱导神经炎症,并进一步加剧焦虑行为。药理学干预实验显示,广谱神经免疫抑制剂及CCR2抑制剂均能有效缓解焦虑症状。此外,在高脂诱导的糖尿病小鼠中,该TonEBP-CCL2-焦虑轴仍然存在,且非胰岛素依赖的降糖药物可改善焦虑表型。进一步研究表明,中央前额叶皮层和腹侧海马脑区的神经元特异性CCL2过表达可诱发焦虑行为。基于糖尿病患者的转录组学分析,本研究发现神经元的TonEBP-CCL2轴及相关炎症通路在糖尿病患者大脑中显著上调,表明该机制可能在临床上具有重要意义。
综上所述,本研究揭示了糖尿病小鼠焦虑行为的神经炎症机制,并强调了该机制在外周代谢紊乱与焦虑障碍的疾病交互中发挥关键作用。
上海药物所-中国药科大学联培博士研究生潘凯俊为本文的第一作者。上海药物所李佳研究员和临港实验室臧奕研究员为本文的共同通讯作者。此外,李佳课题组博士后纵海潮、张咏梅、漆莹贝,副研究员汪翰林,研究生高雅楠、陈文港、周婷、赵晋雯、尹涛和郭浩然亦有重要贡献。该项工作得到了国家重点研发计划、上海市科技重大专项、国家自然科学基金、临港实验室专项等项目的资助。
全文链接:https://www.nature.com/articles/s42255-025-01281-2
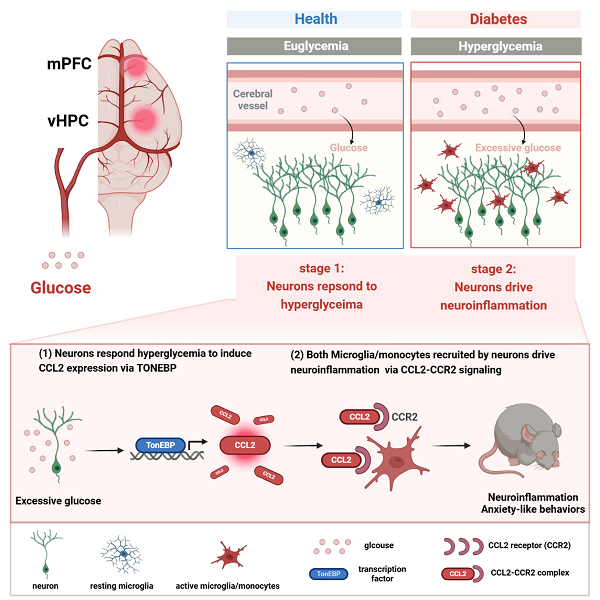
图-神经元CCL2作为糖尿病和焦虑障碍的疾病交互关键机制
(供稿部门:李佳课题组)







































































































































































































































