Adv Mater | 个性化纳米疫苗激活B细胞介导抗肿瘤免疫应答
2024年12月23日,中国科学院上海药物研究所李亚平团队在Advanced Materials上发表了题为“Personalized multi-epitope nanovaccine unlocks B cell-mediated multiple pathways of antitumor immunity”的研究论文。该研究构建了一种基于肿瘤细胞膜囊泡的个性化纳米疫苗,通过向B细胞提供多重活化信号,全面触发抗肿瘤固有、细胞和体液免疫应答,从而实现高效抗肿瘤作用。

随着B细胞对肿瘤进展和治疗的影响逐渐被揭示,B细胞已从癌症免疫治疗的“旁观者”转变成“参与者”。B细胞既可以分泌肿瘤特异性抗体,也可以向T细胞提呈抗原,同时参与抗肿瘤细胞免疫和体液免疫。B细胞受体更敏感、更强大的抗原识别能力为开发针对B细胞的肿瘤疫苗提供了依据。基于单一组分抗原的疫苗难以对抗异质性肿瘤,保留了多价抗原的肿瘤细胞膜是良好的抗原供体,然而,细胞膜衍生的肿瘤疫苗免疫原性弱,需要加以改良才能有效克服肿瘤免疫耐受。
基于上述背景,该研究构建了一种个性化多表位肿瘤疫苗,通过在肿瘤细胞膜囊泡上使用小分子交联剂偶联两种免疫增强剂——激动性CD40抗体(aCD40)和CpG,制备靶向B细胞的肿瘤纳米疫苗CM-CpG-aCD40。CM-CpG-aCD40可主动靶向并蓄积在外周免疫器官,通过肿瘤细胞膜上的抗原与B细胞受体的结合、aCD40与CD40的结合以及CpG与Toll样受体9的结合,为B细胞提供多重活化信号,促进B细胞的抗体分泌和抗原呈递能力。该纳米疫苗还能通过促进树突状细胞熟化从而激活CD8+ T细胞,并重编程肿瘤相关巨噬细胞至M1表型。通过对体液免疫、细胞免疫和固有免疫的全面激活,该疫苗在三阴性乳腺癌小鼠模型中达到了89.3%的肿瘤生长抑制率。
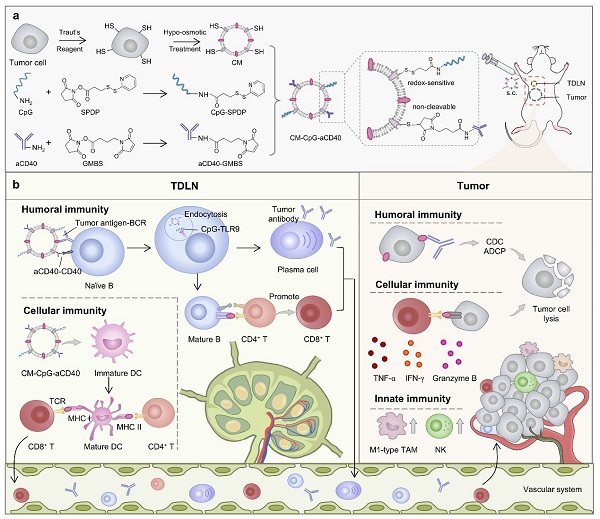
图-多表位个性化肿瘤疫苗CM-CpG-aCD40的制备和功能
该研究构建的纳米疫苗利用了B细胞在抗肿瘤免疫中的多种功能(抗体分泌和抗原呈递)实现对肿瘤生长的控制,揭示了B细胞作为调节靶点的重要潜力,为设计靶向B细胞的肿瘤疫苗提供了参考。
上海药物所博士研究生颜雯璐为论文第一作者。上海药物所李亚平研究员、尹琦研究员为本文共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金、山东省自然科学基金和山东省实验室等项目的资助。中国科学院上海高等研究院国家蛋白质科学研究(上海)设施对实验予以支持。
原文链接:https://doi.org/10.1002/adma.202411361
(供稿部门:李亚平课题组;供稿人:颜雯璐)







































































































































































































































