赖氨酸在人体蛋白质组中的丰度较高(5.9%),参与了蛋白-蛋白相互作用、酶催化活性和翻译后修饰等重要的生理功能。许多蛋白质活性位点附近都存在着赖氨酸残基,相对保守不易发生突变。因此,生理环境下对靶蛋白的赖氨酸残基进行位点选择性修饰的方法在药学领域应用前景广阔。
通常赖氨酸的ε-氨基在生理环境中易于质子化,故在生理条件下对靶蛋白的赖氨酸残基进行共价修饰极具挑战。近年来,国内外报道了几种可用于赖氨酸的共价修饰剂,如硫(VI)氟化物、活化酯、N-酰基或N-烷基磺酰胺、迈克尔受体和醛等,但普遍水溶性较差,而且反应性高,往往存在选择性和毒性等方面的问题。到目前为止,尚未见任何基于赖氨酸共价修饰合理设计的药物上市。因此,业界迫切需要开发出具有良好选择性、水溶性和低毒性的赖氨酸共价修饰剂,以满足各种生物医学应用的需求。
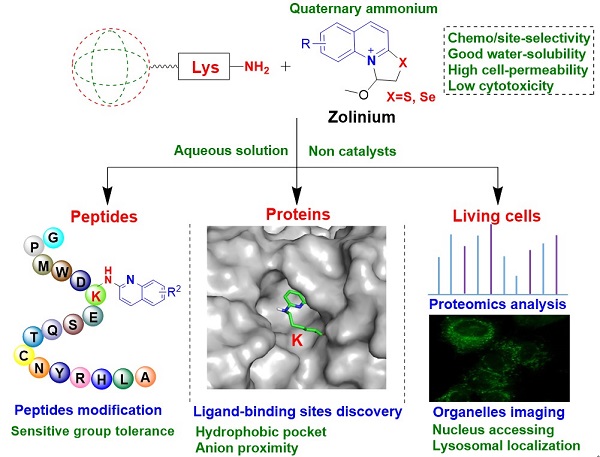
近日,中国科学院上海药物研究所李波副研究员和朱维良研究员联合上海中医药大学葛广波教授,基于团队之前开发的正丁醇溶液中伯氨基修饰方法[1],设计并开发了一类新型水溶性“唑啉铵”(Zolinium),成功实现了在无添加任何催化剂的生理环境下选择性修饰肽和蛋白的赖氨酸残基,计算模拟了该选择性修饰的机制,并进一步应用于绘制活细胞蛋白的赖氨酸修饰谱,相关研究工作于2022年8月23日在线发表于J. Med. Chem.杂志[2]。
该研究表明,这种新型的水溶性唑啉铵化合物能够选择性地修饰肽类药物如普拉莫林衍生物、奥曲肽和索玛鲁肽主链的赖氨酸残基,以及牛血清白蛋白的K350和SARS-CoV-2 3CLpro的两个高度保守的赖氨酸残基(K5和K61),且SARS-CoV-2 3CLpro因发生赖氨酸共价修饰而被灭活。在细胞水平,该唑啉铵还可以用于绘制活细胞中赖氨酸修饰的蛋白质谱,且带有唑啉铵弹头的荧光分子能够对亚细胞器(例如溶酶体)进行成像。蛋白池实验表明,位点选择性修饰主要发生于疏水或催化活性口袋中,并且可能受邻近氨基酸残基阴离子的影响而增强。此外,八种不同氨基酸、带有潜在反应残基的不同肽的混合物修饰实验表明,新型水溶性唑啉铵在肽和蛋白质的赖氨酸喹啉基化过程中选择性好、对各种官能团具有良好的耐受性。量子化学计算结果表明,相对于各种氨基酸残基上的其它反应性基团,赖氨酸ε-氨基与唑啉铵的反应具有最低的自由能垒,揭示该类唑啉铵共价修饰赖氨酸的化学选择性是由反应自由能垒控制的。由于唑啉铵的喹啉环可被进一步修饰而得到各种衍生物,有望在特定用途的肽和蛋白质以及活细胞水平上的蛋白赖氨酸修饰研究领域中发挥重要作用。
综上,本研究开发的一类新型水溶性唑啉铵可对肽、蛋白及活细胞蛋白赖氨酸进行化学和位点选择性修饰,在化学生物学和创新药物研究中具有潜在应用价值。
图1、水溶性“唑啉铵”修饰肽和蛋白的赖氨酸残基及在细胞水平的应用
该论文的第一作者为上海药物所博士生孙海国和硕士生奚萌宇,以及上海中医药大学博士生金强,通讯作者为上海药物所李波副研究员和朱维良研究员,以及上海中医药大学葛广波教授。研究工作得到了国家自然科学基金、国家重点研发计划等基金的支持。
以上水溶性“唑啉铵”的开发是基于团队十多年来持续开展黄连素结构优化的研究工作基础。最初基于黄连素结构设计合成了抗肿瘤活性和理化性质改善的七元环黄连素类化合物[3,4],生物利用度较黄连素有了极大的改善(从F<1%提高到F=21.4%)。在优化合成七元环黄连素类化合物的过程中,发现了一类新型缩醛重排反应[5]及其关键中间体唑啉季铵盐化合物DCZ0358。一方面,该化合物能够通过双重抑制 mTORC1/2活性,发挥体内外抗多发性骨髓瘤活性[6],还能够作为药化优势骨架,衍生化设计合成具有辅助抗肿瘤作用的季铵盐型hCES2A抑制剂[7]。另一方面,以DCZ0358为基础,首次研究了其唑啉季铵盐核心骨架与杂原子(氧、氮、硫)亲核试剂的区域选择性化学偶联反应[8],工作发表后次年即被化学综述杂志引用,作为“阳离子-π”作用控制化学反应区域选择性的例子(Chem Rev. 2018)。还据此设计合成了一类具有体内外抗炎活性的新化合物,并发现只有R手性构型的该类化合物才具有抗炎活性以及与雌激素受体β选择性结合的活性[9]。由此经过持续的结构优化,逐步实现了在正丁醇溶剂中选择性地修饰氨基酸衍生物和肽的伯氨基[1],以及目前可在生理环境下对肽、蛋白和活细胞蛋白的赖氨酸进行化学和位点选择性修饰[2],为靶标发现和共价药物设计提供了一类新型的阳离子弹头-水溶性“唑啉铵”。
参考文献:
[1] Peng Liu, Bo Li,* Mengyu Xi, Zhaoqiang Chen, Haiguo Sun, Xiajuan Huan, Xuejun Xu, Yong Zhang, Kun Zou, Xiangrui Jiang, Zehong Miao, Jinggen Liu, Jingshan Shen, Kaixian Chen, Weiliang Zhu.* Metal-free quinolylation of the primary amino groups of amino acid derivatives and peptides with dihydrooxazolo[3,2-a]quinoliniums. Green Chem. 2019, 21, 4231-4237.
[2] Haiguo Sun,# Mengyu Xi,# Qiang Jin,# Zhengdan Zhu, Yani Zhang, Guihua Jia, Guanghao Zhu, Mengru Sun, Hongwei Zhang, Xuelian Ren, Yong Zhang, Zhijian Xu, He Huang, Jingshan Shen, Bo Li,* Guangbo Ge,* Kaixian Chen, Weiliang Zhu.* Chemo- and Site-Selective Lysine Modification of Peptides and Proteins under Native Conditions Using the Water-Soluble Zolinium. J Med Chem. 2022, doi.org/10.1021/acs.jmedchem.2c00937.
[3] Bo Li,# Gaihong Wang,# Mu Yang, Zhijian Xu, Bubing Zeng,* Heyao Wang,* Jingshan Shen, Kaixian Chen, Weiliang Zhu.* Overman rearrangement and PomeranzeFritsch reaction for the synthesis of benzoazepinoisoquinolones to discover novel antitumor agents,Eur. J. Med. Chem. 2013, 70: 677-684.
[4] Shuaikang Chang,# Bo Li,# Yongsheng Xie,# Yingcong Wang, Zhijian Xu, Shuhan Jin, Dandan Yu, Huaping Wang, Yumeng Lu, Yong Zhang, Ruye Ma, Cheng Huang, Weiming Lai, Xiaosong Wu, Weiliang Zhu,* Jumei Shi,* DCZ0014, a novel compound in the therapy of diffuse large B-cell lymphoma via the B cell receptor signaling pathway, Neoplasia, 2022, 24(1): 50-61.
[5] Bo Li,# Gaihong Wang,# Zhijian Xu, Yong Zhang, Xiangui Huang, Bubing Zeng, Kaixian Chen, Jiye Shi,* Heyao Wang,* Weiliang Zhu.* Discovery of N-substituted 3-arylisoquinolone derivatives as antitumor agents originating from O-substituted 3-arylisoquinolines via [2,3] or [3,3] rearrangement,Eur J Med Chem. 2014, 77: 204-210.
[6] Lu Gao,# Bo Li,# Guang Yang,# Peng Liu, Xiucai Lan, Shuaikang Chang, Yi Tao, Zhijian Xu, Bingqian Xie, Xi Sun, Yingcong Wang, Liangning Hu, Dandan Yu, Yongsheng Xie, Wenxuan Bu, Xiaosong Wu, Weiliang Zhu,* Jumei Shi.* Dual inhibition of mTORC1/2 by DCZ0358 induces cytotoxicity in multiple myeloma and overcomes the protective effect of the bone marrow microenvironment. Cancer Lett. 2018, 421: 135-144.
[7] Lixia Ding,# Lu Wang,# Kun Zou,# Bo Li,* Yunqing Song, Qihua Zhang, Yitian Zhao, Zhijian Xu, Guangbo Ge,* Bo Zhao,* and Weiliang Zhu.* Discovery of dihydrooxazolo[2,3-a]isoquinoliniums as highly specific inhibitors of hCE2. RSC Adv. 2019, 9, 35904-35912.
[8] Bo Li,# Susu Xue,# Yang Yang,# Jia Feng,# Peng Liu, Yong Zhang, Jianming Zhu, Zhijian Xu, Adrian Hall, Bo Zhao,* Jiye Shi,* and Weiliang Zhu.* Regioselectivity and Mechanism of Synthesizing N-Substituted 2-Pyridones and 2-Substituted Pyridines via Metal-Free C-O and C-N Bond-Cleaving of Oxazoline[3,2-a]pyridiniums, Sci Rep. 2017, 7: 41287.
[9] Bo Li,# Heng Li,# Zhengdan Zhu,# Caigui Xiang, Zhijian Xu, Chen Fan, Yitian Zhao, Chunlan Feng, Haiguo Sun, Yong Zhang, Tingting Cai, Wei Tang,* Weiliang Zhu.* Discovery of Chiral N-2’-aryletheryl-1’-alkoxy-ethyl substituted arylisoquinolones with anti-inflammatory activity from the nucleophilic addition reactions of the thiophenols and oxazolinium, Eur J Med Chem. 2021, 222: 113583.