上海药物所合作开发兼具基质穿透和内质网靶向功能的siRNA口服高效递送技术
2025年11月19日,中国科学院上海药物研究所团队与上海健康医学院附属周浦医院团队合作于Advanced Materials在线发表题为“Akkermansia Muciniphila-Inspired Oral siRNA Delivery by Active Matrix-Penetration and Intracellular Endoplasmic Reticulum Accumulation”的研究工作。该研究利用肠道益生菌Akkermansia muciniphila的膜囊泡(AMVs)构建出新型口服siRNA递送系统,克服胞外基质和胞内降解屏障,实现了小干扰RNA(siRNA)的高效口服给药,并在小鼠结直肠癌模型中取得超过90%的肿瘤抑制率。这一研究为口服核酸药物的发展带来新机遇。
siRNA介导的RNA干扰在肿瘤、炎症和代谢性疾病等多种疾病的治疗中展现出广阔前景,已开发出包括脂质纳米粒、聚合物、外泌体等多种纳米递送系统,旨在增强其稳定性、促进其基质渗透与细胞摄取,并实现有效的溶酶体逃逸。然而,siRNA在口服递送领域仍面临着关键挑战。肠道黏液层屏障严重限制了siRNA的口服生物利用度。同时,胞内的内体-溶酶体途径,导致大量siRNA降解,严重削弱其基因沉默效果。因此,亟需开发新型高效的递送载体来充分释放siRNA的治疗潜能。
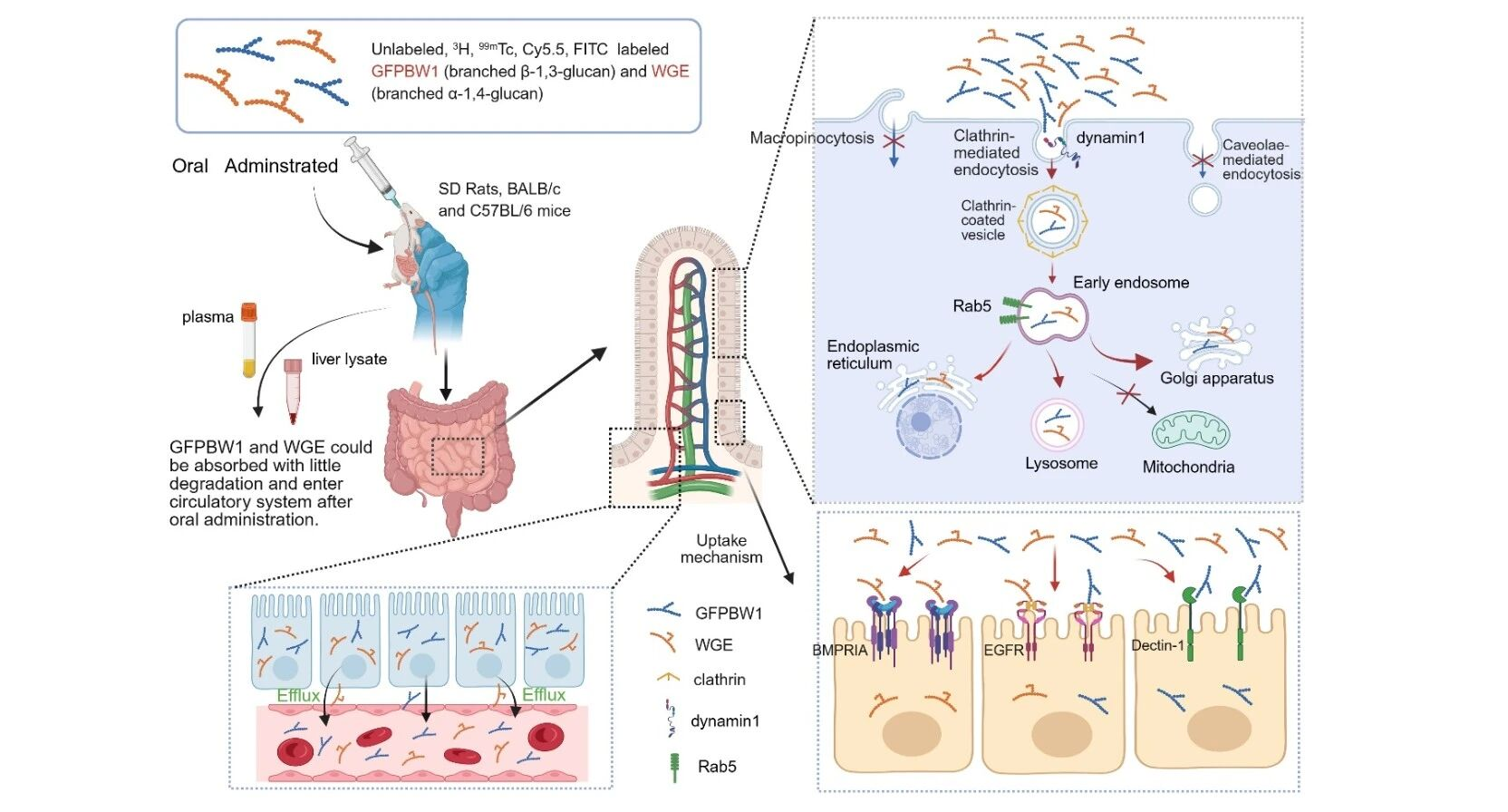
该论文提出了一种新颖的仿生策略,用以突破口服核酸递送的两大障碍。研究发现AMVs能够携带和AKK菌相似的黏蛋白降解酶,主动清除肠道黏液屏障,实现对肠屏障的高效跨越;同时,AMVs在胞内具有独特的高尔基体–内质网运输通道,将siRNA精准送抵细胞内的蛋白质合成中心,有效规避传统的内涵体–溶酶体降解。凭借这种“主动穿透+精准投递”的双重机制,AMVs显著提升了基因沉默效率,明显优于常规脂质体载体。在结直肠癌动物模型中,该技术展现出卓越的治疗效果,肿瘤生长抑制率高达91.6%,并显著延长小鼠生存期。此外,由于AMVs为天然的益生菌来源,具有良好的体内安全性。作为一种兼具高效性与生物安全性的递送平台,AMVs为口服基因药物的开发提供了新思路,并在肿瘤免疫治疗等多个领域展现出广阔的应用潜景。
上海药物所甘勇研究员和上海健康医学院严育忠主任为该论文共同通讯作者。上海药物所副研究员潘超、硕士生王洋和博士后张敏为该论文共同第一作者。该研究获得了中国科学院上海高等研究院国家蛋白质科学研究(上海)设施的技术支持,以及国家杰出青年科学基金、国家重点研发计划项目、上海市重点项目、国家生物药技术创新中心“揭榜挂帅”技术攻关项目、上海市分子影像学重点实验室建设项目等资助。
全文链接:https://doi.org/10.1002/adma.202515901
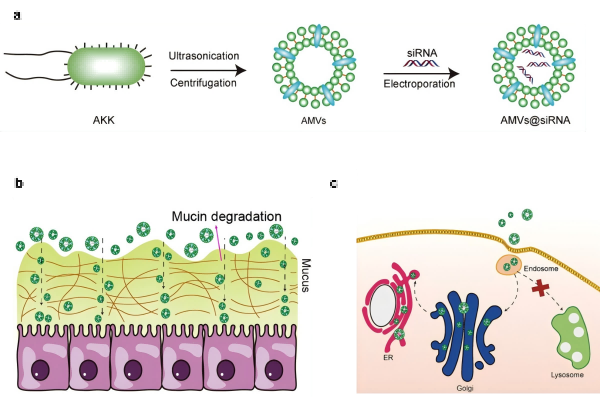
图1,仿生递送系统的设计和作用机制示意图。a,仿生递送载体的制备;b,通过降解黏蛋白实现高效黏液穿透;c,通过高尔基体向内质网转运高效靶向内质网。
(供稿部门:甘勇课题组)