JACS封面 | 上海药物所合作揭示海洋天然产物CHC抗结直肠癌的铜死亡机制
2025年9月22日,中国科学院上海药物研究所李序文团队联合烟台新药创制山东省实验室郭跃伟团队、海军军医大学张卫东团队和上海中医药大学刘三宏团队,在国际知名学术期刊Journal of the American Chemical Society在线发表题为“Marine Natural Product Chagosendine C Induces Cuproptosis in Colorectal Cancer Cells by Targeting FDX1”的最新研究成果,并被选为封面文章。通过对海洋天然产物库的筛选,团队发现了天然的铜配位二聚体生物碱Chagosendine C(CHC)具有较强抗肿瘤活性,并通过合成化学、化学生物学等多学科交叉,系统阐述了CHC靶向FDX1蛋白诱导肿瘤细胞铜依赖性死亡的创新发现,为克服结直肠癌耐药性提供了新策略。
近年来,结直肠癌(CRC)的发病率和死亡率持续攀升,已成为医学研究的焦点领域。由于早期缺乏特异性临床症状,约25%的患者初诊时已处于晚期,且治疗后约50%-60%的患者会发生复发或转移,导致其总体死亡率居高不下。尽管当前分子靶向治疗和免疫治疗取得了一定进展,但由于耐药性或复发的发生,其临床疗效仍有限。这些挑战凸显了亟需深入理解CRC进展的分子机制,并确定新的治疗靶点,以开发更有效的治疗策略。铜作为人体必需的微量元素,在多种关键生物过程中发挥核心作用,其生理功能的正常发挥依赖于细胞内铜离子水平的精准调控。一旦细胞内铜浓度超过进化保守的阈值,便会干扰细胞代谢,导致三羧酸循环中脂酰化酶蛋白的异常聚集以及铁硫簇蛋白的丢失,最终诱发一种新型的铜依赖性细胞死亡(铜死亡)。这一非凋亡性细胞死亡机制的发现,为杀伤肿瘤细胞、克服耐药性提供了全新思路,有望成为结直肠癌治疗的有效策略。
海洋天然产物以其结构多样性和独特化学性质,已成为新药研发的重要宝库,尤其在抗癌药物发现方面展现出巨大潜力。从海洋天然产物中筛选出CHC,这是一种天然形成的铜配位二聚体生物碱(Naamidine J, NJ),具有良好的抗结直肠癌活性。本研究中,研究人员合成了CHC及其类似物,即NJ与镍、钴、锌离子配位的复合物Co(NJ)2、 Ni(NJ)2, 和Zn(NJ)2, 并解决了金属离子络合物样品纯化和表征的难题,为后续生物活性对比研究奠定了基础。体外实验证实,CHC能显著抑制HCT116和RKO两种结直肠癌细胞的增殖,阻滞细胞周期进程并诱导细胞死亡;值得注意的是,它对奥沙利铂耐药的结直肠癌细胞同样具有杀伤作用。在动物模型中,CHC也有效抑制了小鼠皮下移植瘤的生长。深入的机制研究表明,CHC通过靶向作用于FDX1蛋白,导致肿瘤细胞内铜离子与活性氧(ROS)水平显著升高,从而触发细胞死亡。综上所述,CHC为结直肠癌治疗提供了一种基于铜死亡机制的新型策略,展现出广阔的研究前景。
上海药物研究所硕士研究生陶晓玉(现上海中医药大学博士生),上海中医药大学硕士研究生王红茹、副研究员王群,和上海实验动物研究中心王成稷为论文共同第一作者。海军军医大学张卫东教授、上海中医药大学刘三宏研究员、中国科学院上海药物研究所李序文研究员、烟台新药创制山东省实验室郭跃伟研究员为本文共同通讯作者。该工作得到国家重点研发计划,国家自然科学基金,中国科学院B类先导专项,生命过程小分子调控全国重点实验室,山东省海洋服务业重点项目,山东省重点研发计划,山东省泰山学者工程和烟台市科技创新与发展计划基础研究项目等资助。
全文链接:https://pubs.acs.org/doi/10.1021/jacs.5c07917

JACS封面
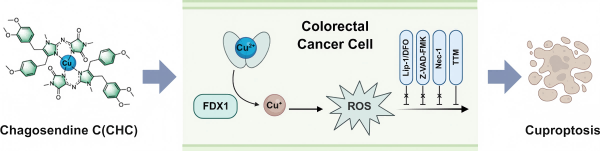
海洋天然产物CHC抗结直肠癌的铜死亡机制
(供稿部门:李序文课题组)







































































































































































































































