Theranostics | SPOP低表达促进膀胱癌肿瘤干性和巨噬细胞招募极化
近期,中国科学院上海药物研究所黄锐敏课题组与复旦大学实验动物中心严俊课题组、复旦大学附属浦东医院朱汝健团队和大坪医院刘秋礼团队联合在Theranostics杂志上发表了题为“SPOP downregulation promotes bladder cancer progression based on cancer cell-macrophage crosstalk via STAT3/CCL2/IL-6 axis and is regulated by VEZF1”的研究论文,并被遴选为封面论文。该研究证实了SPOP通过靶向降解STAT3癌蛋白来降低膀胱肿瘤细胞的干性以及对肿瘤相关巨噬细胞(TAM)的招募和极化。
尿路上皮癌(UBC)是一种以其高复发率和高死亡率而著称的恶性肿瘤。肿瘤干性样细胞(Cancer Stem-like Cell, CSC)的存在是导致这一现象的关键因素之一。而肿瘤干性的维持不仅受到内在信号通路的影响,还受到肿瘤微环境(Tumor microenvironment,TME)乃至更广泛的肿瘤宏环境(Tumor macroenvironment,TMaE)等外在因素的共同调控。研究团队在先前的研究中陆续发现,肿瘤相关成纤维细胞(CAF)和血液中氧化型LDL(ox-LDL)对UBC肿瘤干性的调控作用(Cancer Res.2021和2023)。
肿瘤间质中TAM是一群不可忽视的免疫细胞群体。巨噬细胞的招募和极化在介导肿瘤细胞--肿瘤间质相互作用中扮演着举足轻重的角色,可促进肿瘤生长、免疫逃逸和复发。因此,靶向TME内的CSC和巨噬细胞之间的串扰将会是一种很有希望的癌症治疗策略。
本研究发现,E3泛素连接酶SPOP在多数UBC患者中下调,可促进肿瘤干性和免疫抑制TME的形成。SPOP的下调导致负责UBC干性调控的关键蛋白STAT3蛋白的稳定性上升,趋化因子CCL2表达和分泌增加,从而促进巨噬细胞的募集和向M2型样的极化;在正反馈回路中,极化的巨噬细胞分泌细胞因子IL-6,进一步激活UBC细胞中的STAT3信号通路,从而维持肿瘤干性。此外,该研究还发现转录因子VEZF1的缺失是导致UBC患者中SPOP mRNA水平降低的关键驱动因素,而VEZF1与SPOP的共同下调预示着UBC患者的预后不佳。
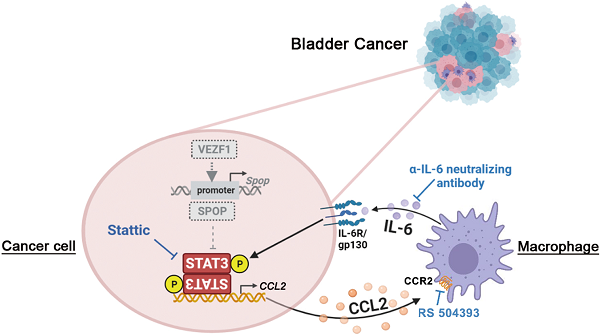
工作模式图:低表达水平的SPOP使其降解底物STAT3蛋白水平升高,进而促进膀胱癌CSC特性及对TAM的招募和极化。
这项研究揭示了SPOP在尿路上皮癌(UBC)中扮演的抑癌基因角色,提出了可通过靶向CCL2的受体CCR2或靶向IL-6的中和性IL-6抗体来抑制UBC恶性进展的新策略,为SPOP表达低下的UBC患者提供了潜在的治疗新途径。科研团队借用《庄子·大宗师》“泉涸,鱼相与处于陆,相呴以湿,相濡以沫,不如相忘于江湖”中成语“相濡以沫”,描绘了在肿瘤内在选择压力下,TME中TAM与CSC之间协同调控形成的共栖关系。

封面图:在肿瘤内部恶劣的环境中,SPOP表达水平降低的膀胱肿瘤细胞(红鱼)通过释放趋化因子CCL2来吸引巨噬细胞(黑鱼)。作为响应,巨噬细胞释放细胞因子IL-6,辅助肿瘤细胞的增殖和干性维持,形成了一种促进肿瘤恶性生长的共生关系。这种互作关联揭示了肿瘤微环境中细胞间复杂的相互作用,也凸显了肿瘤进展中的关键调控机制。
本研究得到了国家自然科学基金、上海市科技重大专项、上海市科委和上海市卫健委等的项目资助。
全文链接:https://www.thno.org/v14p6543.htm
(供稿部门:黄锐敏课题组)