Nat Rev Endocrinol 综述丨上海药物所概述冷冻电镜在GPCR药物发现中的突破性研究
2024年2月29日,中国科学院上海药物研究所徐华强/段佳团队在Nature Reviews Endocrinology上发表了题为“Cryo-electron microscopy for GPCR research and drug discovery in endocrinology and metabolism”的研究综述。该综述深刻探讨了冷冻电镜(Cryo-EM)在理解和开发以GPCRs为靶点药物的革命性影响。文章着重介绍了GPCR配体识别、受体激活、G蛋白偶联、arrestin蛋白募集以及GPCR激酶调控的一般结构特征和原理。其中,尤其强调了偏向性配体对于GPCRs信号的精确调控,为治疗内分泌和代谢疾病的药物研发提供了个性化治疗策略的可能性。此外,综述指出在不同位点受到不同别构配体调节的GPCRs为药物开发和治疗策略提供了新的启示。这一研究对推动内分泌和代谢疾病药物领域的发展具有重要的指导作用。
冷冻电镜技术(Cryo-EM)的应用让科学家能够细致入微地观察蛋白质微观传感器,这不仅让科研人员更深入地理解人体细胞之间的通讯机制,还为激素和药物反应的研究提供了巨大的推动力,将为糖尿病、肥胖症和高血压病等疾病的药物研发带来革命变革。
G蛋白偶联受体(GPCRs)是一个庞大而多样的跨膜蛋白家族,已知的GPCR受体超过800多个,在多个生理过程中(包括内分泌代谢途径)发挥着至关重要的作用。作为细胞表面最大的受体家族,GPCR代表了细胞与环境之间的重要接口,能够将来自外部的各种信号(如光子、味觉、嗅觉、神经递质和激素)转化为细胞内部的响应。随着结构生物学的不断进步,尤其是X射线晶体学的先驱,再加上近年来冷冻电子显微镜技术的迅猛发展,科研人员对于GPCR跨膜信号传导的认识日益深刻。值得一提的是,在过去的十年里,冷冻电子显微镜技术的迅猛进步彻底改变了结构生物学的面貌,为科研人员提供了对蛋白质结构和功能,特别是GPCR的深入洞察。自2017年科学家首次通过低温电子显微镜解析的GPCR结构亮相以来,冷冻电镜在GPCR研究领域的应用迅速扩展。
一 冷冻电镜加速GPCRs信号传导机制的研究
GPCR的激活通过一系列牵涉到多种细胞内信号传导分子的步骤来启动细胞内信号级联反应。在参与GPCR信号传导的关键组分中,G蛋白起着关键作用,它们充当分子开关,负责将信号从受体传递到下游效应器。根据Gα亚基的序列同源性,G蛋白可分为四个亚家族:Gs/olf,Gi/o,Gq/11和G12/13,每个亚型都能激活特定的下游效应器。G蛋白以其特有的序列同源性细致地调控信号传导。除了G蛋白,GPCR信号通路还受到阻遏蛋白(arrestin)和激酶(GRKs)的调控。Arrestin作为适配体与磷酸化的GPCR相互作用,引发受体的脱敏、内化和启动替代信号级联。研究表明,GPCR含有与疾病相关的单核苷酸多态性(SNP),这些变异可能影响受体的激活、脱敏或内化过程,从而导致代谢性疾病的严重发展。GRK对激活的GPCR进行磷酸化,促进arrestin的招募,进而调节GPCR信号。G蛋白、arrestin和GRK之间的这种相互作用有助于微调和调节GPCR介导的信号事件。G蛋白和arrestin的偶联是调控GPCR不同生物反应的关键机制,也是GPCR靶向药物发挥疗效的重要途径(见图1)。这些组分之间的动态相互作用确保了对GPCR信号的精确时空调控,使其能够协调多种生理过程。在GPCR研究的新兴领域中,一个重要方向是鉴定和开发偏向性配体,它们能够选择性地激活或抑制由GPCR介导的特定下游信号通路。相较于非偏向性配体,偏向性配体通过专门作用于所需的信号通路,在GPCR药物发现中具有明显的优势。这种精确、有针对性的调控方式使偏向性激动剂能更有效地发挥药理作用,为调节GPCR功能提供了一种更为精密的途径。
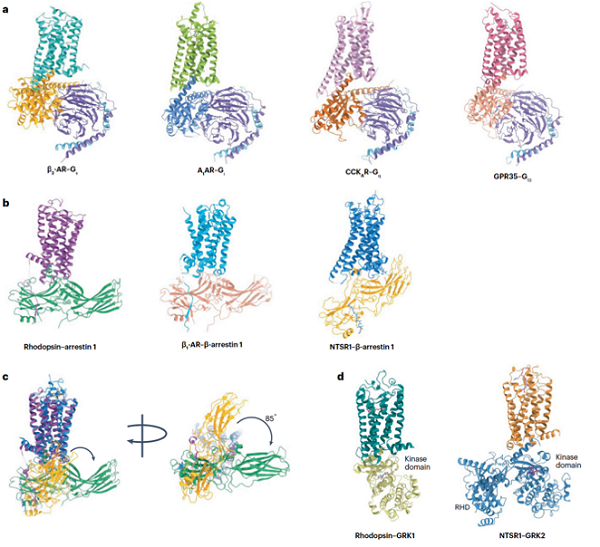
图1 GPCR受体下游不同信号传导机制
在过去的7年里,科研人员见证了GPCR结构生物学领域的显著进展,主要得益于冷冻电镜技术的引入,这是一项强大的技术,能够可视化近原子结构的细节。冷冻电镜技术的出现彻底改变了对GPCR的研究,因为它能够以高分辨率确定这些膜蛋白在不同功能状态下的结构,包括与拮抗剂结合的失活状态、无配体的静息状态(apo结构)以及与激动剂和别构配体结合的部分或完全激活状态,为科研人员理解它们的功能和进行药物发现提供了巨大的潜力。
冷冻电镜在GPCR结构生物学方面的杰出成就之一是解析了不同类型GPCR的大量结构。自冷冻电镜问世以来,通过这一技术解析的GPCR结构数量呈指数级增长,已超过650个,超过了X射线晶体学解析结构数量的30%以上,自2017年以来通过冷冻电镜解析的GPCR结构以每0.63年翻一倍(见图2)。根据这一进展速度的趋势,科研人员预计在未来5-6年内,人类整个GPCR超家族中超过90%的GPCR结构将被解析出来。
除了单个GPCR结构外,冷冻电镜还实现了GPCR与信号转导复合物结构的可视化。目前已确定了GPCR与不同细胞内信号转导因子(包括所有亚型的G蛋白和arrestin)的复合物结构,揭示了GPCR介导的信号转导的结构基础。此外,冷冻电镜还帮助揭示了GPCR与GRKs的作用机制,以及细胞内激动剂如何特异性地调节GPCR下游G蛋白或arrestin通路的偏向性激活,为偏向性信号传导提供了结构基础。
冷冻电镜在解析GPCR结构的速度令人震惊,彻底改变了GPCR的药物发现。这意味着科研人员正以前所未有的速度揭示出许多关于人体关键信号传递的蓝图,为医学开辟了新的前沿。这预示着一个新时代的到来,在这个时代,长期以来困扰人类的疾病将能够比以往更有效地被治疗。站在这个新前沿的边缘,冷冻电镜在增进科研人员对人体的理解和开发突破性治疗方法方面的潜力从未如此显著。
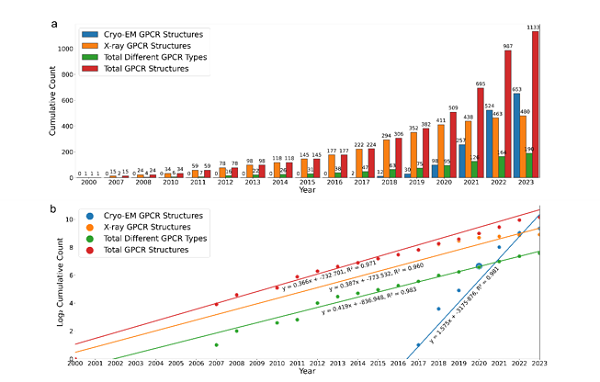
图 2 冷冻电镜实现对GPCR结构解析的革命性突破,加速对全蛋白质组GPCR结构解析,预计在未来5-6年内,人类整个GPCR超家族中超过90%的GPCR结构将被解析出来
二 偏向性别构调控药物是GPCR药物开发的重点
深入探究GPCR的结构就如同拥有锁的详细图纸,使得科研人员能更轻松地设计出与之完美契合的“钥匙”(这里指的是药物)。这种精准医疗方法有望从根本上改变对一系列疾病的治疗方式,为更有效、目标更准确的疗法带来新的希望,同时降低了副作用的风险。作为细胞表面受体,GPCR在靠近细胞膜外侧包含一个由7次跨膜螺旋构成的正构配体结合位点。由于GPCR配体的多样性(从生物胺等小分子配体到脂质、多肽和蛋白),GPCR配体结合口袋呈现出不同的形状和大小,每一种配体都具有适应相应配体的独特拓扑结构。其中共同的特征是跨膜口袋内的一个关键“切换开关”残基(例如,在大多数A类GPCR中是W6.48),该残基的构象对于受体激活至关重要。激动剂的结合会引发W6.48构象的变化,从而诱导跨膜螺旋6(TM6)从非激活状态向外移动,使受体激活。
GPCR对G蛋白亚型和arrestin的选择性主要取决于TM6的关键结构特征和受体的磷酸化状态。例如,Gs偶联的受体在激活时其TM6会向外移动14-20 埃,而Gi偶联受体的TM6向外移动7-10 埃。相较于Gi偶联受体,Gs偶联受体的TM5较长而TM6较短,以适应Gs和Gi蛋白表面拓扑结构的不同。除了TM6之外,其他结构元素也有助于G蛋白亚型的偶联选择性。例如,Gq偶联受体(如GAL2R)含有一个独特的胞内环2(ICL2),以增强受体与Gq的相互作用。相较之下,G12/13偶联受体(如GPR35)在TM1和TM2胞质末端附近含有一个独特的甲硫氨酸口袋,能够容纳G12/13的C端甲硫氨酸残基。GPCR招募arrestin的前提是必须被磷酸化并处于活化状态,其TM6向外移动7-10 埃,与Gi偶联受体的活化状态相似。GPCR信号从G蛋白介导的通路向arrestin通路的转换取决于GRKs的功能,GRKs是一个由七个成员组成的小型激酶家族。
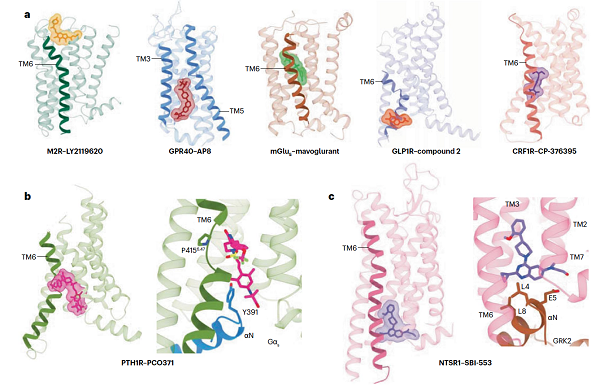
图 3 GPCR受体存在多样的别构位点
除了受正构配体的调控外,GPCR还受到别构配体的调控。对别构配体如何影响GPCR信号的研究可能是冷冻电镜未来最有价值的方向之一。例如,目前为治疗2型糖尿病(T2DM)而开发的大多数GPR40靶向药物都是基于靠近受体ICL2的别构结合位点。通过观察别构配体结合的GPCR结构,可以发现GPCR存在多个别构结合位点(图3)。这些别构位点的发现对靶向GPCR的别构调控药物开发具有重要的指导意义。
三 内分泌代谢疾病相关的GPCR靶点成为药物研究热点
GPCR已成为代谢性疾病的有望治疗靶点,包括肥胖、2型糖尿病、非酒精性脂肪性肝病和非酒精性脂肪性肝炎。GPCR参与调节关键的代谢过程,如葡萄糖合成、摄取、胰岛素分泌和细胞分化生长。其中,GLP1R、GPR40和GPR120被发现在人类胰岛中发挥关键作用,是治疗肥胖症和2型糖尿病的重要靶点。其他GPCR,如GCGR和β-ARs,参与糖代谢、脂质合成和糖异生的调节。在肥胖病中,GPCR也影响脂肪分解、产热、葡萄糖管理、脂肪因子和细胞因子释放等过程。GPCR一直被认为是各种内分泌系统疾病药物研究的关键靶点。肽类激素与B类GPCR的结合效力和选择性在很大程度上取决于受体的ECD, B类GPCR 的结构解析为设计高选择性或多靶向肽配体提供了详细的模板,包括GLP1R、GIPR和GCGR的双重或三重激动剂。
总之,冷冻电镜的出现深刻推进了科研人员对GPCR结构和功能的理解,深入了解GPCR偏向性别构调控药物开发的结构基础,有望为内分泌代谢性疾病提供更有效、副作用更小的治疗方式。
本项研究的第一作者为段佳,通讯作者为徐华强研究员和段佳研究员。本项研究得到了国家重点研发计划项目、国家自然科学基金、中国科学院战略性先导科技专项的支持、上海市市级科技重大专项等的支持。
作者介绍
徐华强,中国科学院上海药物研究所研究员,课题组长,博士生导师,中科院上海药物研究所药物靶标结构与功能中心主任。主要从事激素受体结构与功能研究和药物研发。目前已发表SCI论文280余篇,其中在CELL, NATURE, SCIENCE主刊论文 38篇,引用次数超过36,000次,连续多年被评为“全球高被引学者”,并获得专利十余项。研究成果曾被Science杂志评为“2009年十大突破之一”、入选“2014年度中国科学十大进展”、入选两院院士评选“2015年中国十大科技进展新闻”、入选“2019年度中国医学重大进展(药学部)”和入选中国科学院上海分院2022年度科技创新“十大进展”(基础研究类) 。2016年荣获国际蛋白质学会Hans Neurath奖和“药明康德生命化学研究奖”杰出成就奖。2019、2021、2022和2023年荣获中国科学院优秀导师奖。2020年荣获上海市“白玉兰纪念奖”。2021年荣获第十三届“谈家桢生命科学成就奖”。2022年荣获第二十二届“吴阶平-保罗‒杨森医学药学奖(吴杨奖)”。2022年荣获第九届“侨界贡献奖”一等奖。2022年荣获上海市“白玉兰荣誉奖”。
段佳,中国科学院上海药物研究所研究员,课题组长,博士生导师。主要从事与代谢相关GPCR的结构及功能研究。目前已以第一作者兼通讯作者在Nature(3篇)、Nature Communications、Cell Reports等国际知名期刊发表论文9篇。曾获得吴瑞奖学金,入选中国科学院上海分院抢占制高点青年攀登计划、中国科协第八届青年人才托举工程项目、上海科技青年35人引领计划、上海市青年科技英才扬帆计划等。课题组常年招聘博士后、科研助理及联合培养博士生,欢迎感兴趣的老师和同学联系。(duanjia@simm.ac.cn)
原文链接:https://www.nature.com/articles/s41574-024-00957-







































































































































































































































