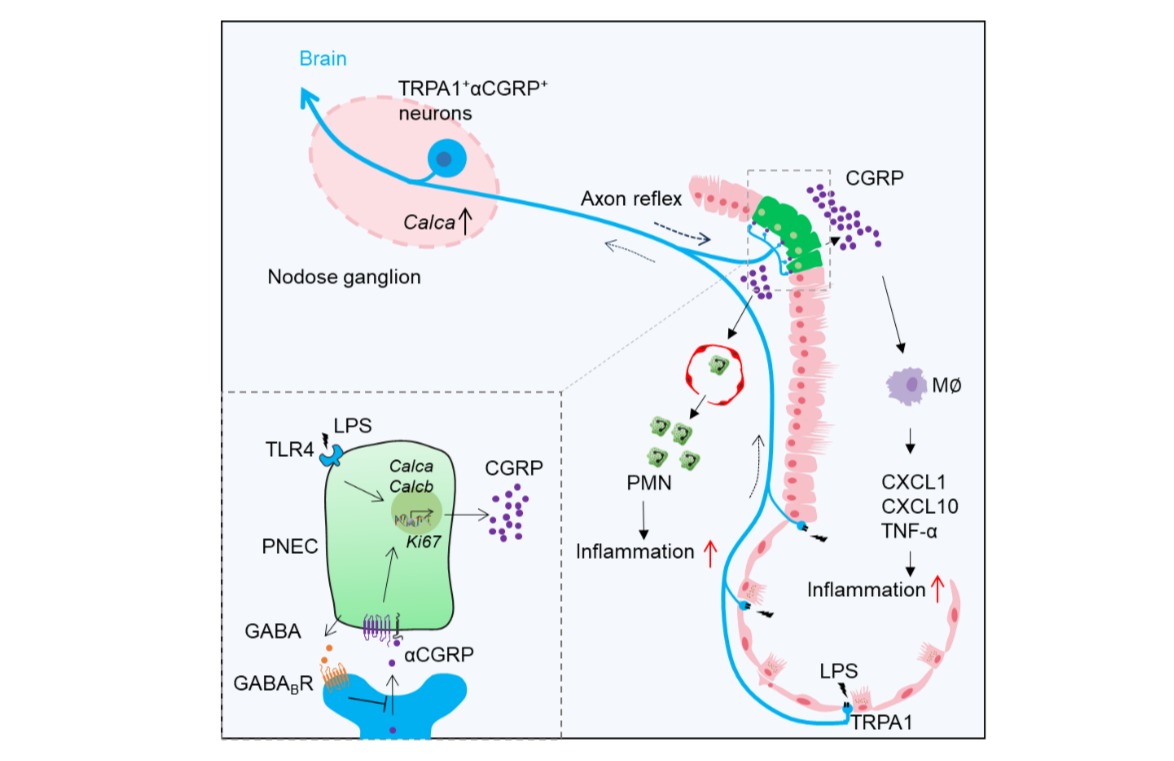
Nat Commun │ 上海药物所发展时空可分辨的“蛋白质修饰调控酶—底物”全局性解析新方法
近日,中国科学院上海药物研究所陈小华课题组与谭敏佳课题组合作,在Nature Communications期刊发表题为“Spatiotemporal and direct capturing global substrates of lysine-modifying enzymes in living cells”的研究论文。在该项研究中,科研团队利用前期开发的PANAC光点击化学,发展了一种在活细胞内直接捕捉“修饰调控酶—底物”相互作用的时空可分辨解析新方法,为蛋白质相互作用和蛋白质翻译后修饰研究提供了新工具。
蛋白质修饰调控酶影响诸多蛋白质功能并参与系列生物学过程,精确解析“修饰调控酶—底物”的动态互作对于深入理解蛋白质功能和靶标发现具有重要意义。然而,利用现有技术直接进行“修饰调控酶—底物”的时空动态全局性解析,尤其对动态和微弱相互作用产生的修饰底物、修饰位点的准确鉴定,非常具有挑战性。作为直接捕捉“修饰调控酶—底物”动态互作策略的概念性验证,陈小华、谭敏佳团队基于前期发展的化学生物学工具(Chem 2019, 5, 2955; Nat. Commun. 2020, 11, 5472; Nat. Chem. 2023, 15, 803),发展了一种在活细胞中直接捕捉赖氨酸酰基化修饰酶的全局性底物新方法(图1)。
本项研究中,通过整合酰基化修饰调控酶的催化机制、及在酶活性口袋中定点引入的赖氨酸残基选择性交联的非天然氨基酸,科研人员实现了对多种原核系统的赖氨酸修饰调控酶(PatZ、YiaC、LplA、TmcA、YjaB)和真核系统的赖氨酸修饰调控酶(Tip60、GCN5)底物的直接捕捉和全局性解析,发现了新底物、新修饰位点和蛋白质新功能。其中,研究发现PatZ的新底物AcrA-K131乙酰化修饰能够影响多药外排泵AcrA-AcrB-TolC的形成,从而调控多药外排泵对抗生素的外排功能。
该项研究中全局性修饰底物的发现,扩展了对蛋白质翻译后修饰酶的机制、潜在修饰底物、蛋白质功能的认识;新底物的发现及功能验证为相关疾病机制的研究提供了新的思路,也为蛋白质动态相互作用的调控提供了新途径。该策略的成功实现,能够启发更多其他类型的蛋白质翻译后修饰调控酶—底物的直接捕捉和全局性解析方法的发现,也为蛋白质相互作用及靶标发现相关的研究提供了有效的化学生物学工具。
上海药物所副研究员胡昊,博士后胡伟、郭安娣,副研究员翟琳辉为本论文的共同第一作者。陈小华研究员、谭敏佳研究员为本论文的通讯作者。该工作得到国家自然科学基金委“生物大分子动态修饰与化学干预”重大研究计划、国家杰出青年科学基金、科技部重点研发计划等项目的支持。此项工作获得中国科技大学姚雪彪教授、刘行教授,北京航空航天大学刘超副教授的大力帮助和支持。
原文链接:https://www.nature.com/articles/s41467-024-45765-3

图1. 本工作发展的直接捕捉“修饰调控酶—底物”的新方法
(供稿部门:陈小华课题组、谭敏佳课题组)