Adv Mater | 多肽构象调控纳米丝的体内行为,提高抗癌药物递送效率
2024年11月28日,上海药物所李亚平团队、上海科技大学张鹏程团队、福建物构所张璐团队联合在Advanced Materials上发表了题为“Conformation Influences Biological Fates of Peptide-Based Nanofilaments by Modulating Protein Adsorption and Interfilament Entanglement”的研究论文。该研究构建了不同两亲性多肽分子自组装形成的多肽纳米丝(PFs),通过调控多肽构象降低PFs的非特异性蛋白吸附,进而改变PFs的体内生物行为,提高抗癌药物递送效率。

自然界广泛存在通过自组装产生形状各异的生物结构,与球形颗粒不同,以微管和胶原蛋白为代表的生物纳米纤维(纳米丝)可利用其特异性和多价结合产生独特的生物学功能,但目前我们对天然纳米丝及人造纳米丝与蛋白质多价生物相互作用还了解甚少。
研究者以带His-Lys-Asp(HKD)羧基端的棕榈酰化的β-折叠形成序列C16-GVVQQHKD(P1)这一两亲性多肽分子为母体,在P1序列基础上分别插入四聚甘氨酸、四聚丝氨酸、四聚脯氨酸、四聚羟脯氨酸以形成不同的两亲性多肽分子(P2-P5),并自组装形成不同的PFs(P1Fs-P5Fs)。通过改变同源四肽,研究者在PFs内施加了不同的构象,这导致了主链分子间氢键密度的显著差异,从而改变了PFs的蛋白吸附量。吸附的蛋白质可以进一步诱导不同程度和模式的PFs丝间缠结,进而影响其生物分布等体内行为。
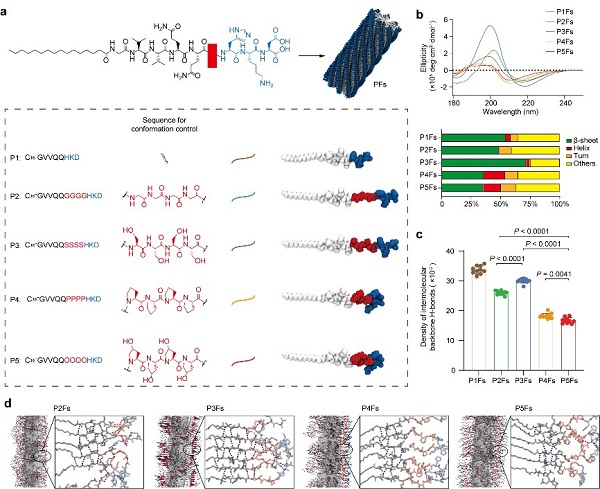
不同PFs的设计构建及表征
其中,主链分子间氢键密度最低、二级结构β-折叠含量最低的P5Fs表现出最少的非特异性蛋白吸附和最小的纤维间缠结。在体内,P5Fs表现出长血液循环、低肝脏清除,并且可以有效提高物理包埋或化学偶联药物的抗肿瘤效果。这一研究发现了纳米丝与蛋白的独特作用模式,揭示了多肽的二级结构调控其非特异性蛋白吸附,进而改变纳米丝生物命运的机制。
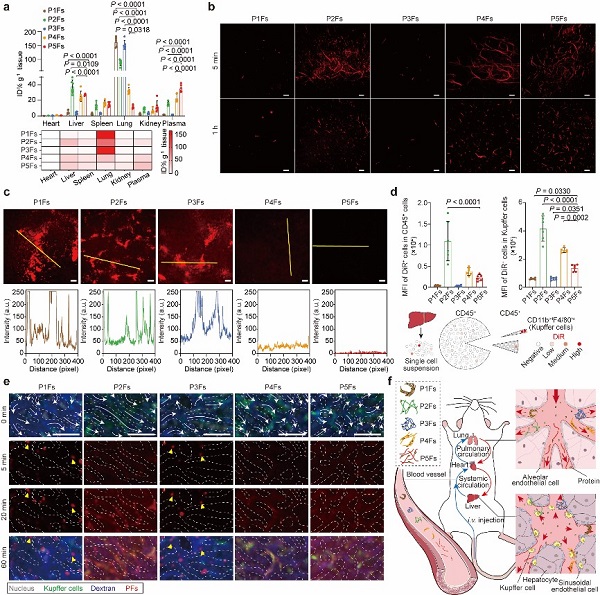
不同PFs的体内生物学行为
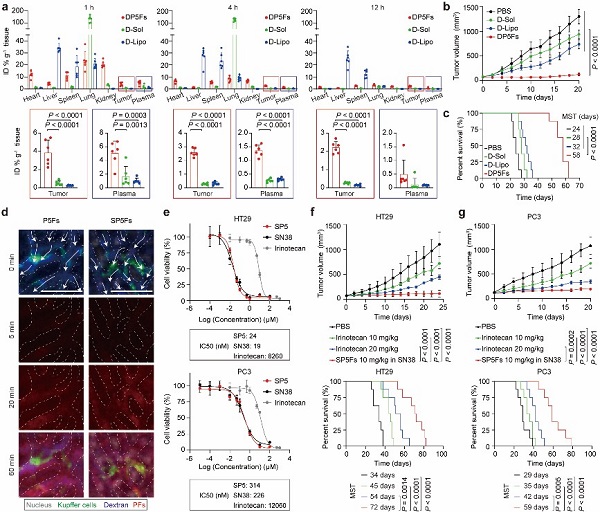
基于P5Fs的纳米丝抗肿瘤效果
上海药物所李亚平研究员、上海科技大学张鹏程研究员、福建物构所张璐研究员为本文的共同通讯作者,上海药物所博士后蔡颖和福建物构所博士研究生徐甜甜为本文共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金、中国科学院等项目的资助。
全文链接:https://doi.org/10.1002/adma.202409130
(供稿部门:制剂中心;供稿人:蔡颖)