上海药物所开发赖氨酸乙酰乙酰化修饰鉴定与功能解析新技术
2026年2月21日,中国科学院上海药物研究所黄河课题组在Science Advances在线发表题为“Covalent Capture and Genetic Code Expansion Enables Chemoproteomic Profiling and Functional Characterization of Lysine Acetoacetylation”的研究论文。该研究构建了融合化学探针标记富集与遗传密码扩展技术的整合平台,实现了对赖氨酸乙酰乙酰化(Kacac)修饰的系统性鉴定与精确位点功能解析。
Kacac是黄河课题组于2023年合作发现的一种由酮体代谢物乙酰乙酸驱动的新型蛋白质翻译后修饰(Adv Sci. 2023, 10: e2300032),广泛存在于哺乳动物组蛋白及非组蛋白中。然而,由于缺乏高特异性、高灵敏度的检测与功能研究工具,Kacac的底物全景图谱与生物学功能始终未能得到系统揭示。
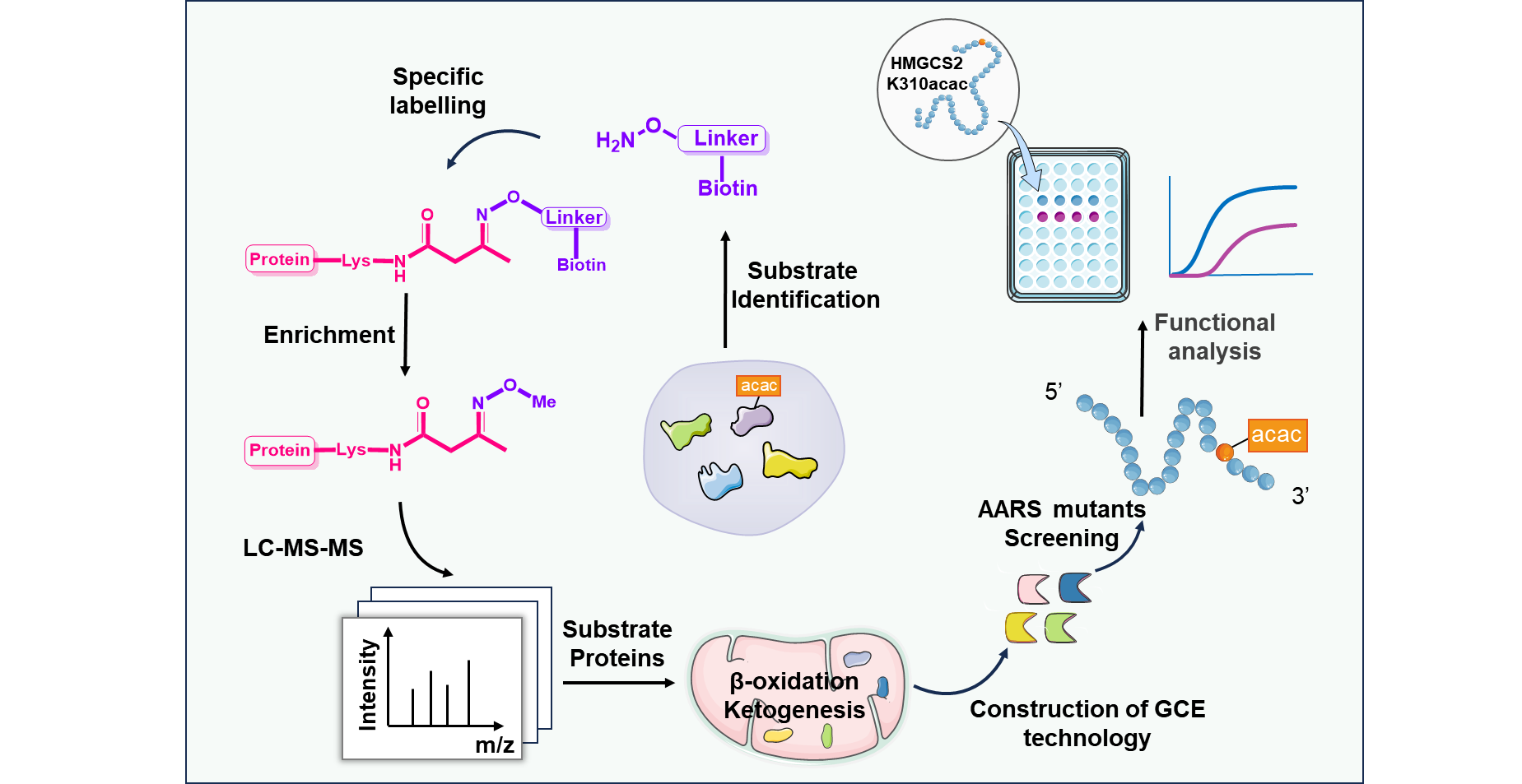
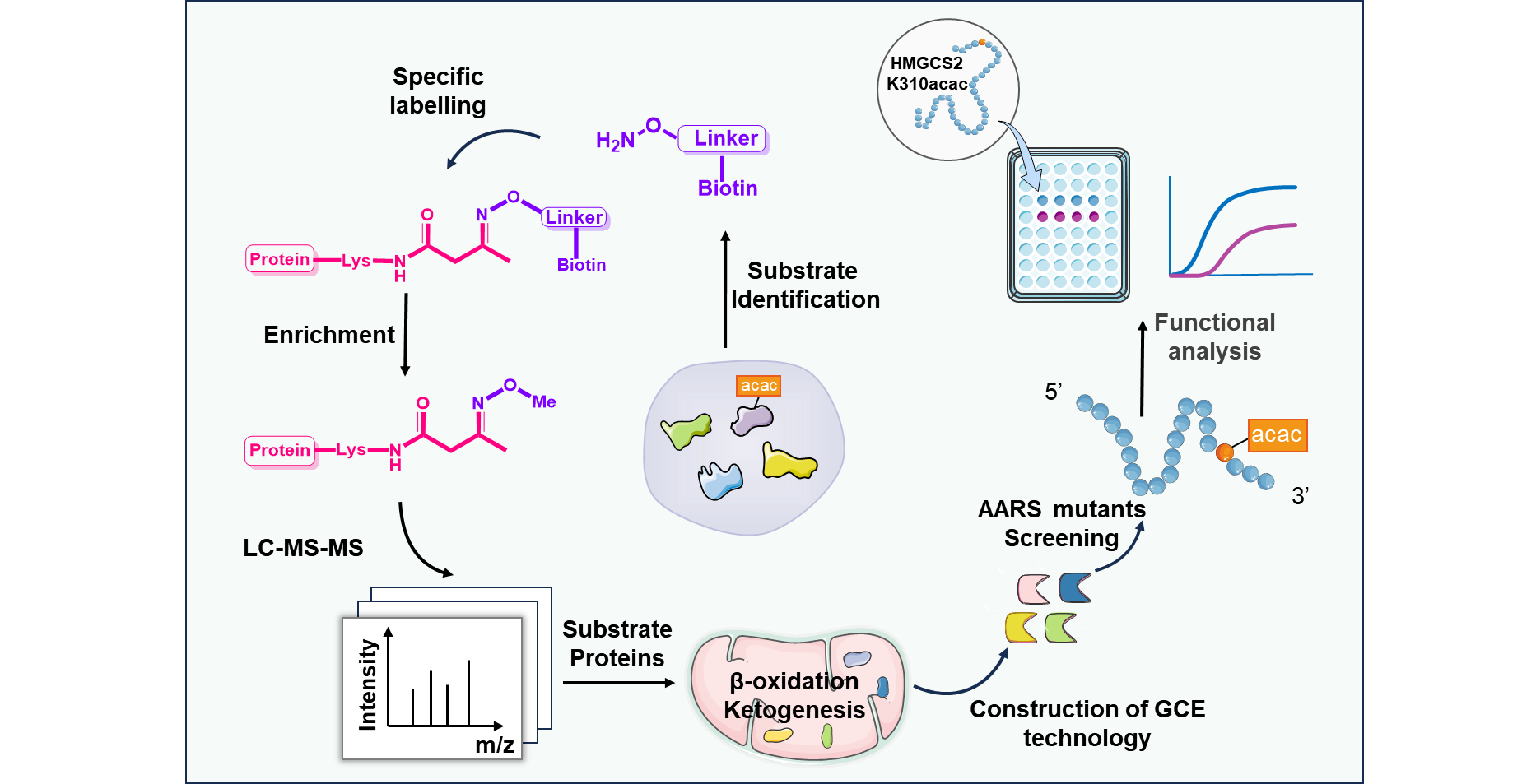
在本研究中,研究团队利用Kacac修饰特有的酮羰基反应活性,设计合成了新型化学探针Aca-Bio。该探针通过与Kacac侧链形成pH响应性可逆肟键,实现了对Kacac修饰肽段的高选择性标记、富集与可控释放。利用该策略对禁食小鼠肝脏进行化学蛋白质组学分析,共鉴定出分布于125个蛋白质上的260个Kacac修饰位点,大幅拓展了已知Kacac底物谱,并揭示了该修饰在三羧酸循环、酮体生成等核心代谢通路中的显著富集。
为深入探究特定位点Kacac修饰的功能意义,团队进一步建立了遗传密码扩展系统,首次在哺乳动物细胞中实现了Kacac的位点特异性精准整合。利用该系统,研究团队针对酮体代谢关键酶——羟甲戊二酰辅酶A合成酶2(HMGCS2)开展了定点功能研究,发现其第310位赖氨酸的高丰度Kacac修饰通过空间位阻效应削弱底物结合,导致酶活性显著下降,提示Kacac可能作为代谢通路中的"分子刹车"参与负反馈调节。该工作开发了从全局性修饰发现到位点特异性功能阐释的分子工具,为深入探索代谢物驱动的蛋白质翻译后修饰在生理病理过程中的作用提供了新方法。
国科大杭州高等研究院药学院助理研究员宋晓翰为本文第一作者,上海药物所黄河课题组研究生芦宇涵、郭欣龙参与本研究,上海药物所黄河研究员为本文通讯作者。该研究得到了中国科学院战略性先导科技专项、国科大杭州高等研究院专项资金及国家自然科学基金等项目的资助。
全文链接:https://www.science.org/doi/10.1126/sciadv.aeb5106
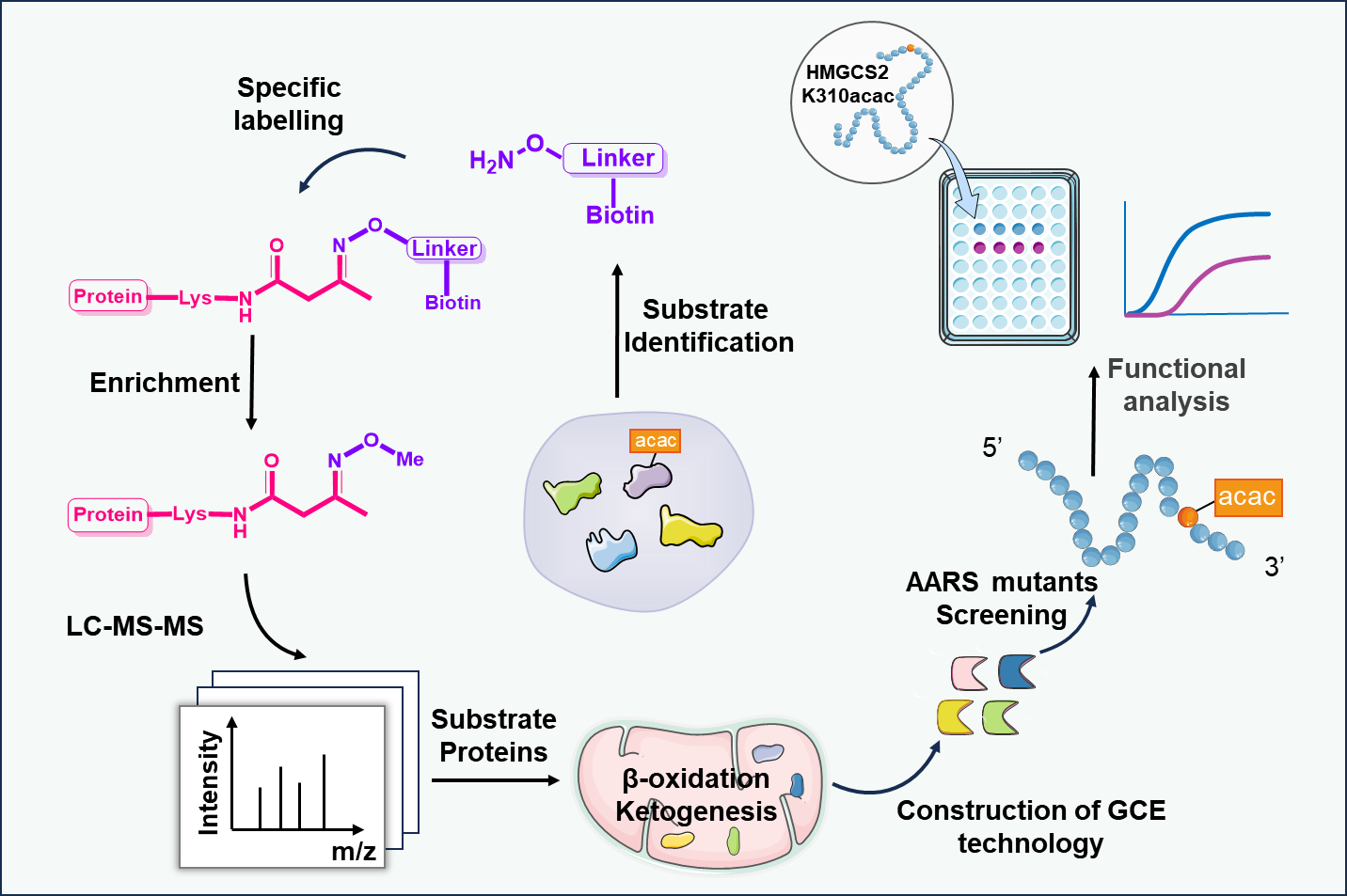
图1. Kacac修饰富集检测与功能研究策略
(供稿部门:黄河课题组)