APSB | 上海药物所开发新型免疫刺激抗体偶联药物增强抗肿瘤免疫应答
免疫刺激抗体偶联药物(Immune-stimulating antibody conjugates,ISACs)是一种创新型ADCs,它将模式识别受体(Pattern recognition receptor,PRR)激动剂与抗体连接在一起,旨在通过激发抗肿瘤免疫反应来阻止肿瘤进展。通过替代直接杀死肿瘤细胞的小分子毒素,ISACs可以扩展到更多种类的肿瘤相关抗原(Tumor-associated antigens,TAA)。然而,受限于狭窄的治疗窗口,ISACs在临床试验中遇到了挑战,迫切需要探索更合适的抗体和PRR激动剂组合,以设计出更安全、有效的药物。深入了解抗体和PRR激动剂对ISACs疗效的作用机制将有助于ISACs的优化。中国科学院上海药物研究所宫丽崑课题组于2022年在Journal for Immunotherapy of Cancer合作发表的前期工作(DOI: 10.1136/jitc-2022-004590),开发了一种PD-L1/TLR7双靶向纳米抗体偶联药物,系统评价了其在多肿瘤模型中的出色抗肿瘤活性,并初步探索了其重塑肿瘤免疫微环境的作用机制。
近日,宫丽崑团队在前期工作基础上,深入探索该类型的ISAC药物中PD-L1抗体和TLR7小分子激动剂各自扮演的角色,并基于此开发了一种形式为偶联TLR7小分子激动剂的非阻断型PD-L1纳米抗体的ISAC药物,并阐明了其通过调控巨噬细胞/NK细胞互作来杀伤肿瘤的机制。该研究论文已于2025年5月16号在线发表于Acta Pharmaceutica Sinica B。
研究团队基于噬菌体展示技术筛选到一株具有PD-L1依赖性内吞作用的非阻断型PD-L1靶向纳米抗体,基于此,发现PD-L1纳米抗体主要起递送TLR7激动剂的作用,无需阻断活性,可优先靶向高表达PD-L1的巨噬细胞并通过内吞实现TLR7小分子激动剂的入胞。而且,非阻断抗体可以规避阻断活性可能带来的毒性风险,并使ISACs药物的设计具有更广泛的TAA靶点。该ISAC可在部分肿瘤模型中实现肿瘤生长完全消退。有趣的是,该ISAC的疗效并不依赖于肿瘤细胞PD-L1和T细胞,而是依赖于宿主细胞的PD-L1,通过调节巨噬细胞M1偏向分化、活化和促进其吞噬肿瘤细胞作用,并促进巨噬细胞招募NK细胞的瘤内浸润和活化,实现强大的抗肿瘤疗效。该形式的ISAC具有临床开发潜力,并可激发其他ISACs疗法的优化。
上海药物所硕士生胡超、博士生陈晨和博士后尉骁璐为本论文的共同第一作者。上海药物所宫丽崑研究员和特别研究助理龙益如为本论文的通讯作者。本研究得到了上海药物所唐峰研究员的大力支持。该工作得到了国家自然科学基金委和中国博士后科学基金会等的资助。
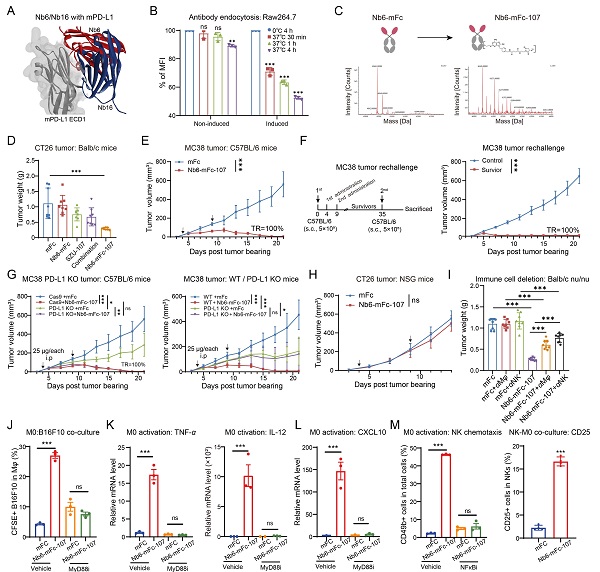
非阻断型PD-L1纳米抗体偶联TLR7激动剂通过巨噬细胞/NK细胞互作介导强效的肿瘤杀伤
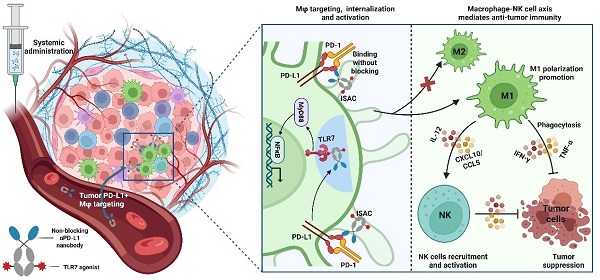
作用机制示意图
原文链接:https://www.sciencedirect.com/science/article/pii/S2211383525003119?via%3Dihub
(供稿部门:宫丽崑课题组)