Nat Commun | 上海药物所合作揭示人类与啮齿动物P2X7受体药物响应种属差异的分子机制
2025年12月2日,中国科学院上海药物研究所柳红研究员团队,联合中国药科大学/兰州大学于烨教授团队和复旦大学服部素之教授团队,在Nature Communications上发表题为“Understanding interspecies drug response variations between human and rodent P2X7 receptors”的研究论文。该工作系统阐明了人类与啮齿类动物在P2X7受体药物响应上的物种差异机制,从结构与药理学层面解析了其分子基础,并进一步构建了规避上述差异的人源化转基因动物模型,用于预测靶向P2X7受体药物的体内药效和副作用,对实现更加精准、高效的药物发现具有重要意义。
P2X7受体是一种由细胞外ATP激活的非选择性阳离子通道,广泛参与炎症、神经免疫调控等生理病理过程,是当前药物开发的热门靶点。然而,人类与啮齿类动物之间P2rx7基因序列的差异,是造成配体对不同物种P2X7受体调控效应显著不同的重要原因。这不仅对P2X7化合物的理性设计构成了巨大挑战,也增加了靶向该受体候选药物从临床前研究向临床转化的难度。
该研究基于对P2X7受体PCP结合位点结构刚性及分区特征的认识,合理设计并合成了小檗碱类似物PSFL1191及其手性异构体PSFL1190。研究发现,尽管PSFL1190与PSFL1191仅存在手性差异,但其对P2X7受体的表观亲和力相差超过50倍。PSFL1191对人源P2X7受体具有显著抑制作用(IC50=0.248±0.017μM),而对小鼠和大鼠P2X7受体的作用较弱,抑制率仅为13.3%和4.94%。相比之下,JNJ-54175446对人源和啮齿类P2X7均表现出较强的抑制作用。这使得PSFL1191成为解析P2X7受体种属差异研究的重要化学小分子探针。
通过冷冻电镜(cryo-EM)结构解析,团队发现存在种属差异的PSFL1191和不存在种属差异的JNJ-54175446均结合于P2X7受体的PCP结构域,PSFL1191的结合位点位于PCP深处,即PCP1亚位点,其异喹啉骨架与周围残基形成紧密的疏水作用,并通过7位N原子与D92形成氢键,C9位O原子与K297形成氢键,增强了化合物与口袋结合的精确性与稳定性。JNJ-54175446的结合位点靠近PCP中部位置,由PCP2亚口袋容纳。二者进入PCP结构域的深浅差异,构成了其物种响应差异的重要结构基础。
进一步的序列比较与功能验证表明,PCP1中丙氨酸A312是导致PCP位点存在种属差异的关键氨基酸,并证实mP2X7A312V突变可显著改变PSFL1191等结合于PCP位点的P2X7抑制剂的物种选择性。基于此,研究团队构建了P2rx7A312V/A312V人源化小鼠模型。在该模型中,PSFL1191对巨噬细胞介导的细菌清除与创伤愈合产生了明显调节效应,而在野生型小鼠中上述效应并不显著。
该研究以PSFL1191和JNJ-54175446为探针,从结构与药理层面揭示了P2X7受体种属药效差异的分子机制,并进一步开发了P2rx7A312V/A312V人源化小鼠评价模型,为存在种属差异性P2X7抑制剂的体内有效性和安全性评估提供了新的研究方法,也为P2X7抑制剂开发提供了良好的先导化合物。
中国药科大学郭常润、复旦大学盛丹琪、上海药物所李纪元和中国药科大学李天天为该论文的共同第一作者,中国药科大学/兰州大学于烨教授、上海药物所柳红研究员和复旦大学服部素之教授为共同通讯作者。本研究得到了国家重点研发计划和国家自然科学基金等多项资助。
全文链接:https://www.nature.com/articles/s41467-025-65847-0
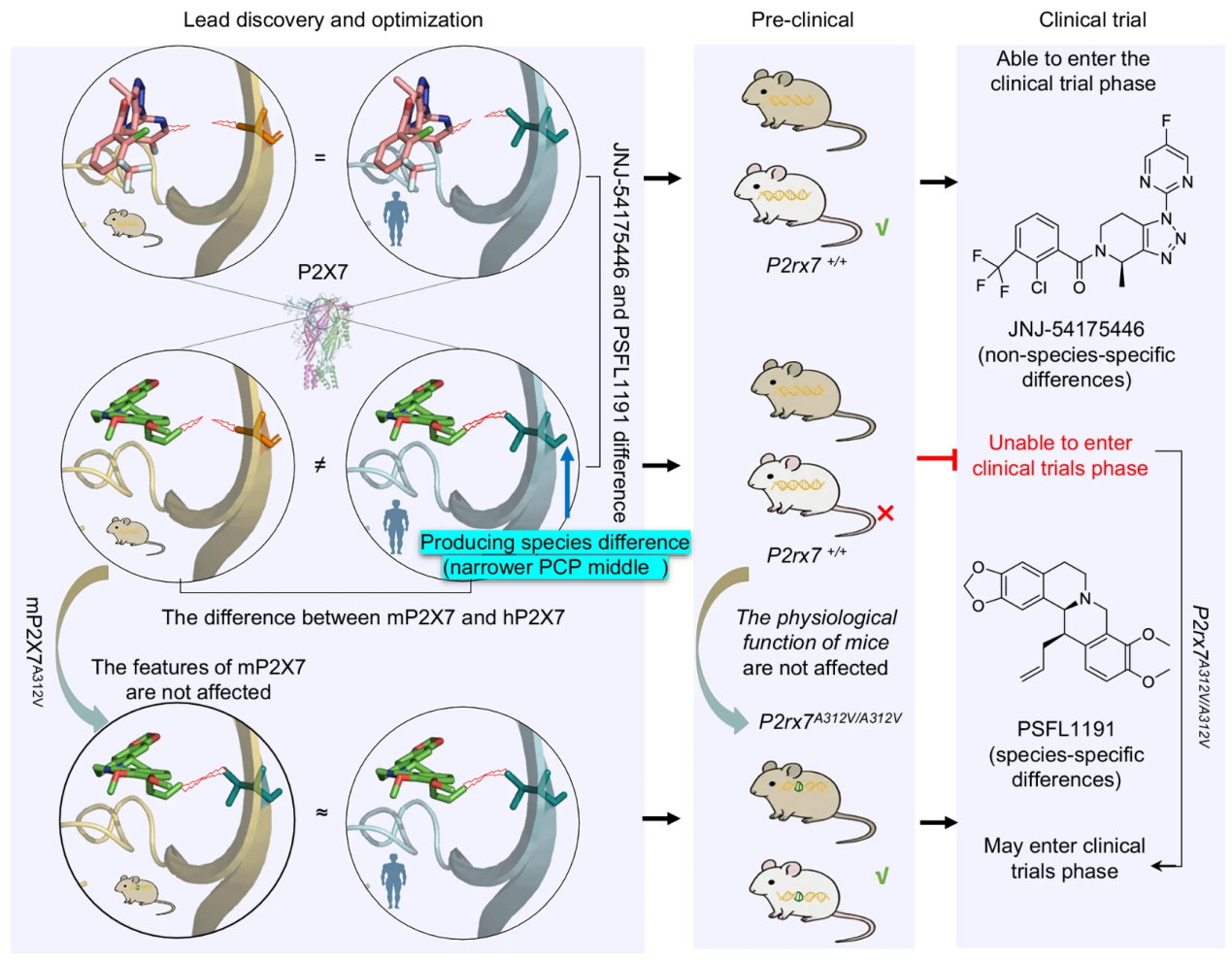
图-人类与啮齿类动物之间P2X7受体抑制剂种属差异的作用机制及其差异消除小鼠模型的构建
(供稿部门:柳红课题组)







































































































































































































































