Adv Mater | 上海药物所构建可电离铁纳米佐剂用于个性化肿瘤疫苗治疗
肿瘤疫苗代表了一种可诱导机体特异性且持久性抗肿瘤免疫应答的治疗手段,对于改善临床肿瘤治疗具有广大的前景。然而,肿瘤抗原的免疫原性低、胞质递送效率低以及淋巴器官靶向性差等问题大大限制了肿瘤疫苗诱导抗肿瘤免疫反应的水平,进而导致临床治疗效果不佳。新型免疫佐剂的开发为改善肿瘤疫苗疗效提供了有力的策略。干扰素基因刺激因子(Stimulator of interferon genes, STING)信号激动剂作为最具前景的免疫佐剂之一,其刺激抗原呈递细胞STING信号激活,诱导I型干扰素(Type I interferon, IFN-I)分泌,从而促进肿瘤抗原的交叉呈递以及后续T淋巴细胞的增殖与活化。然而,游离形式的STING激动剂在作为免疫佐剂参与肿瘤疫苗设计时依然存在淋巴器官递送效率差以及不能改善抗原胞质释放等问题,这也是造成当前水溶性疫苗即肿瘤抗原与免疫佐剂的物理混合制剂临床治疗效果不佳的关键原因之一。因此,开发新一代疫苗制剂以协同促进淋巴器官内肿瘤抗原的胞质递送与STING信号的高效激活,对于改善肿瘤疫苗治疗具有重要的意义。
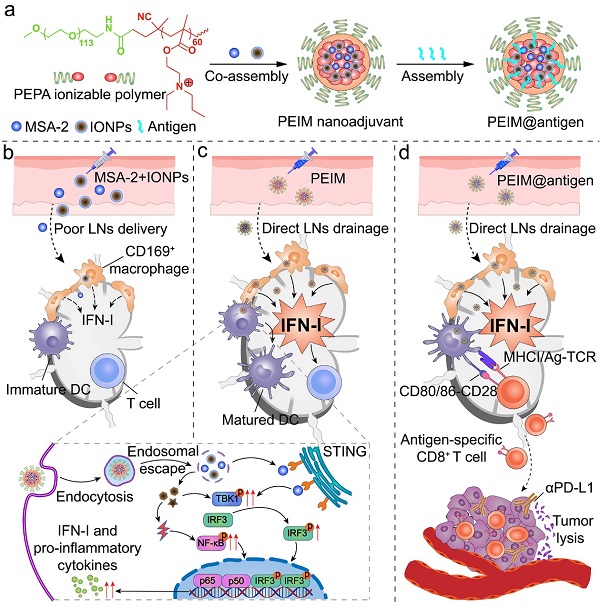
针对上述挑战,于海军课题组2022年12月28日在Advanced Materials上发表了题为“Acid-ionizable iron nanoadjuvant augments STING activation for personalized vaccination immunotherapy of cancer”的研究论文,该研究创新性地构建了可电离铁纳米佐剂文库,以特异性放大引流淋巴结内STING信号的激活。同时,纳米佐剂可普适性高效递送多类形式肿瘤抗原,并在体内诱导强烈且特异的抗肿瘤免疫应答。这项研究成果展示了可电离铁纳米佐剂用于个性化肿瘤疫苗治疗的前景。
研究人员率先证明了氧化铁纳米颗粒(IONPs)这一临床批准的成像造影剂,可通过诱导细胞内活性氧产生与STING激动剂MSA-2协同刺激STING信号激活,诱导IFN-I大量分泌。随后,研究人员设计合成了一系列酸可电离共聚物,并通过其与IONPs和MSA-2的静电相互作用自组装构建可电离铁纳米佐剂文库。该纳米佐剂可高效引流并蓄积至淋巴结,诱导淋巴结内干扰素刺激基因显著表达。与此同时,该纳米佐剂可进一步作为疫苗递送载体,与模式抗原鸡卵白蛋白(OVA)自组装构建肿瘤纳米疫苗。该纳米疫苗在级联激活STING信号的同时,还能有效促进抗原的胞质递送,从而实现高效的抗原交叉呈递,最终诱导了近170倍增加的抗原特异性CD8+ T淋巴细胞反应,并在小鼠B16OVA黑色素瘤模型中表现出显著的肿瘤预防与生长抑制能力。此外,该纳米佐剂还可递送术后切除得到的自体肿瘤细胞膜抗原,以用于肿瘤术后免疫治疗。纳米疫苗与免疫检查点阻断疗法联用后显著抑制了B16OVA和MC38肿瘤的术后复发与远端转移,并诱导长期抗肿瘤免疫记忆效应。总之,可电离铁纳米佐剂代表了一个强大且具普适性的疫苗递送平台,其能够改善肿瘤抗原交叉呈递与T淋巴细胞激活效率,为个性化肿瘤疫苗治疗提供了新的策略。
图1 可电离铁纳米佐剂用于个性化肿瘤疫苗治疗示意图。
上海药物所硕博连读生陈方敏为论文第一作者,上海药物所于海军研究员为本文通讯作者。李天亮博士为本文的实验设计与技术路线优化提供了关键支持。复旦大学罗敏研究员、上海药物所谢左权研究员、华东师范大学徐志爱教授和上海交通大学丁春勇研究员对本课题给予了大力支持。该研究得到了科技部重点研发计划、国家自然科学基金、上海市科委国际合作项目、临港实验室开放基金、博士后基金和上海市超级博士后项目、高分子物理与化学国家重点实验室开放基金和基金委外国青年学者基金等项目的资助。该研究中生物效应评价部分得到了张江实验室国家蛋白质科学研究(上海)设施的大力支持。
(供稿部门:于海军课题组)