Adv Sci | 上海药物所合作开发超广谱抗冠状病毒3CL蛋白酶抑制剂
近日,中国科学院上海药物研究所许叶春研究员团队联合武汉病毒研究所张磊砢研究员团队在Advanced Science在线报道了题为"Structure-Based Development of Ultra-Broad-Spectrum 3C-Like Protease Inhibitors"的研究论文。该研究针对冠状病毒传播潜力及其耐药性挑战,突破了现有3CL蛋白酶抑制剂广谱性不足的局限。通过对“全谱系”冠状病毒3CL蛋白酶进行深度的生物信息学与结构解析研究,设计并获得了具有超广谱活性的3CL蛋白酶抑制剂,为广谱抗冠状病毒药物的研发提供了通用设计策略。
广谱抗冠状病毒药物研发面临全谱系覆盖挑战
近二十年来,SARS-CoV、MERS-CoV及SARS-CoV-2的相继涌现,揭示了冠状病毒高度变异性和传播潜力。与此同时,猪δ冠状病毒(PDCoV)和新型犬-猫重组α冠状病毒(CCoV-HuPn-2018)近期被证实能够感染人类,使得能感染人的冠状病毒数量增加至9种。
3CL蛋白酶因其在冠状病毒复制中的核心作用和高度保守性,被公认为广谱抗冠状病毒药物的理想靶点,已有多个3CL蛋白酶抑制剂获批上市。但本研究首次表明:目前已获批的药物(如奈玛特韦、先诺特韦、恩赛特韦)虽然对β属冠状病毒3CL蛋白酶有效,但在面对其它属类(α、γ、δ)冠状病毒3CL蛋白酶时,其抑制效率显著下降,尤其是针对上述新发现的可感染人的PDCoV和CCoV-HuPn-2018的3CL蛋白酶抑制效率极为微弱。因此,为应对日益复杂的冠状病毒谱系,并储备能抵御未知变异毒株的候选药物,开发能覆盖全谱系“超广谱”3CL蛋白酶抑制剂十分必要。
基于结构的理性设计:突破广谱抑制的“瓶颈”
研究团队首先对涵盖α、β、γ和δ四种属类、26个亚属的59种冠状病毒3CL蛋白酶进行了系统的序列和结构分析,发现底物结合口袋中的S2和S4亚位点是决定抑制剂广谱活性的关键变异区域。随后,研究人员以奈玛特韦为起点,通过解析其与PDCoV和CCoV-HuPn-2018 3CL蛋白酶的高分辨率晶体结构,并与SARS-CoV-2 3CL蛋白酶的复合物结构进行对比分析,揭示了奈玛特韦对两种新病毒3CL蛋白酶活性减弱的分子机制,强调了修饰奈玛特韦P2和P4片段以增强广谱抑制活性的重要性。
基于此,研究团队利用基于结构的药物设计策略对奈玛特韦结构进行优化。研究发现,通过缩小P2片段的体积,同时采用非环状结构,可以避开不同属病毒3CL蛋白酶S2口袋的空间位阻;此外,通过精细调控P4片段,可增强对α属病毒的适应性。经过多轮优化,最终发现了化合物8,该化合物在分子水平和细胞水平对四种属类代表性的3CL蛋白酶均表现出了强效抑制活性,IC50值均小于100 nM,EC50值处于1.2-13.4 μM区间。
“超广谱”活性验证及其通用设计策略的意义
为全面评估化合物8的广谱活性,研究团队进一步拓展了对该化合物的广谱性评价谱系范围。结果显示,化合物8表现出前所未有的抑制谱,对32种涵盖所有亚属的3CL蛋白酶表现出纳摩尔级的强效抑制活性(IC50:19-146 nM),并对多种临床常见的奈玛特韦耐药突变体依然保持高度敏感。此外,细胞水平抗病毒实验结果表明,化合物8对包括HCoV-OC43、HCoV-229E、SARS-CoV-2及其多种变体在内的人类冠状病毒均具有良好抗病毒活性(EC50:0.01-3.3 μM),其体内抗病毒疗效也在HCoV-OC43感染的小鼠模型中得到验证。
尽管化合物8的成药性仍有优化空间,但本研究的核心意义在于系统探索并形成了一套针对广谱抗病毒药物靶点开展“超广谱”抑制剂设计的完整流程和通用策略。这项工作不仅为研发下一代广谱抗冠状病毒药物奠定了重要基础,也为未来应对可能出现的新型病毒提供了前瞻性储备。
上海药物所研究员苏海霞,临港实验室博士生聂添情,国科大杭州高等研究院博士后陈国峰、熊慕雅,武汉病毒所助理研究员张宇旻为本文的共同第一作者。上海药物所许叶春研究员、苏海霞研究员以及武汉病毒所张磊砢研究员为共同通讯作者。该项工作得到了上海同步辐射光源的支持,获得了中国科学院战略性先导科技专项、国家自然科学基金、上海药物所自主部署项目、国家重点研发计划和湖北省自然科学基金杰出青年学者等项目的支持。
全文链接:http://doi.org/10.1002/advs.202512342
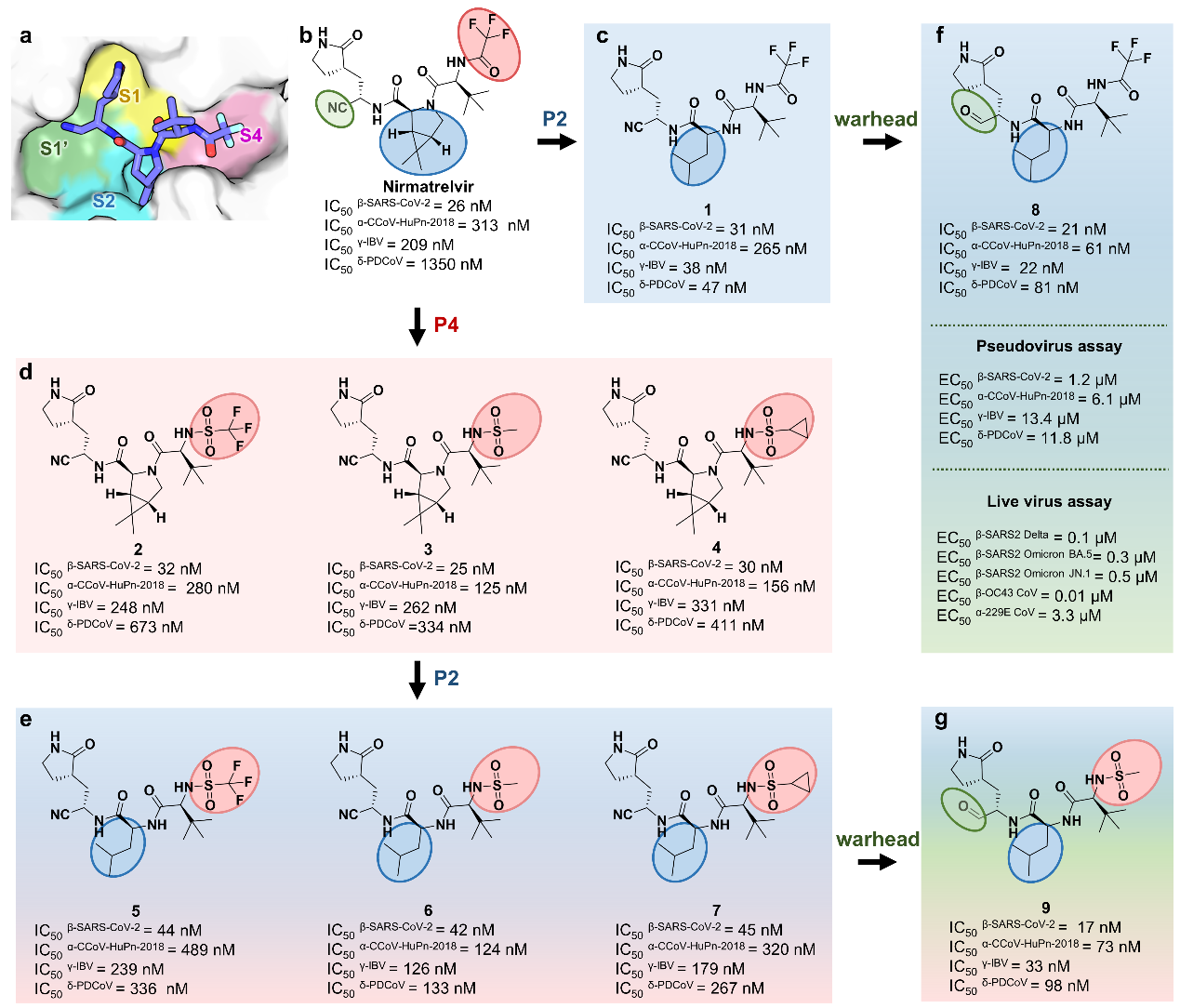
图1. 基于结构的广谱3CL蛋白酶抑制剂的设计与优化
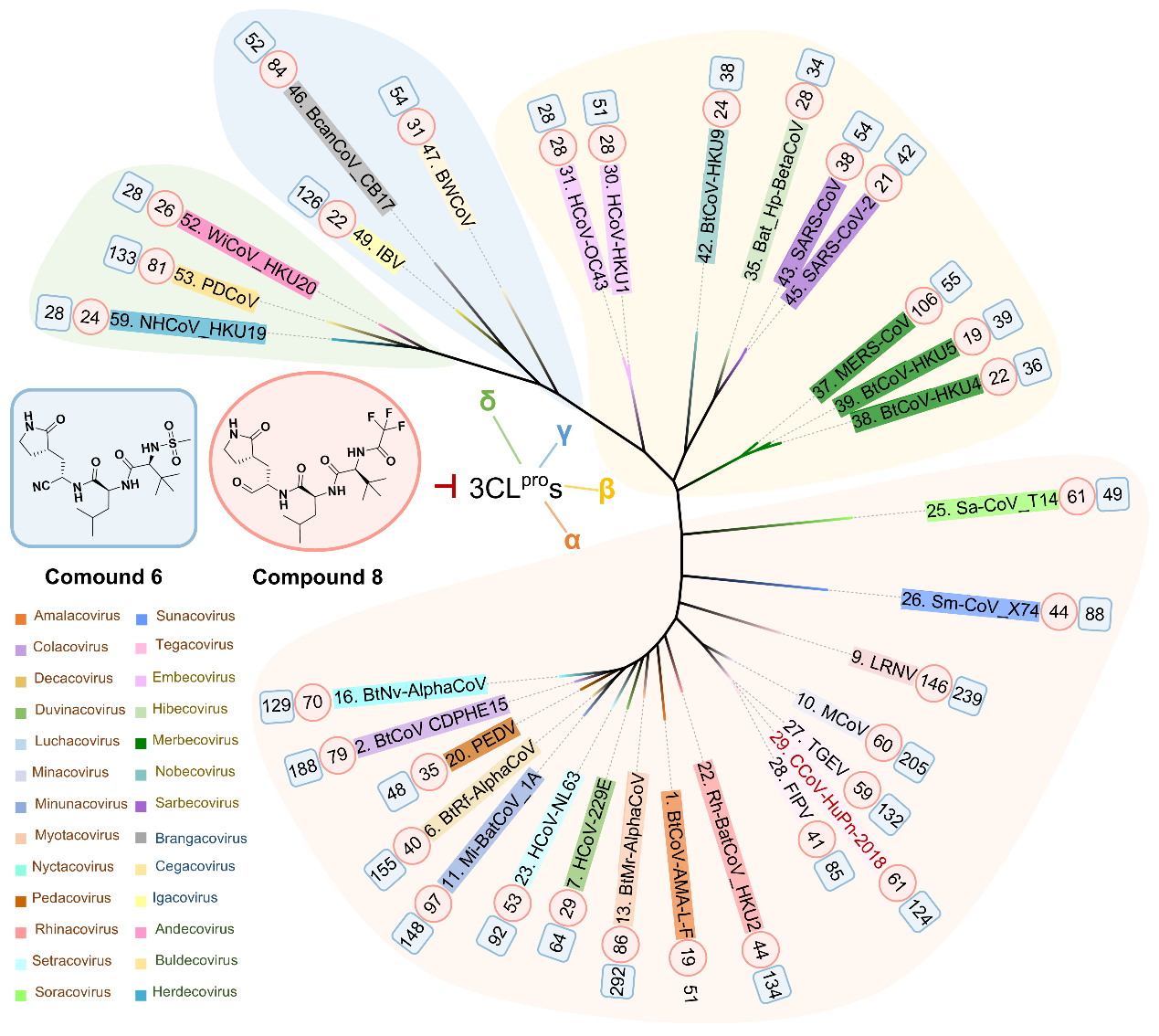
图2. 化合物8的超广谱抑制活性
(供稿部门:许叶春课题组)