Nat Commun | 上海药物所合作揭示肠道细胞吸收天然来源多糖的分子机制
天然多糖具有抗肿瘤、免疫调节、抗病毒、降血糖、抗衰老等广泛而丰富的药理活性,且副作用相对较小,是中药创新药研发的良好源头化合物。然而,中药汤药口服后作为主要的活性物质是否能通过肠道吸收途径进入血液循环到达靶细胞和靶器官发挥临床疗效,哪些基因/关键蛋白发挥了作用?这两个关键科学问题长期困扰领域专家,严重滞后了基于多糖创新药物的研发和中药发挥临床疗效的活性物质基础理解。
大量研究表明,外源性天然多糖经口服后可发挥良好的药理活性,CortellisTM数据库的记录显示约有17种获批或临床研发阶段的多糖类药物为口服给药,但口服给药后的活性多糖如何到达病灶部位仍不清楚。长久以来,多糖庞大的分子量与高亲水性被认为是其穿越肠黏膜屏障的主要阻碍,因而多糖无法被肠道吸收已然成为学界普遍接受的观点。如肝素口服后几乎不透过肠上皮,必须注射给药,但也有零星证据提示在临床实验中高分子量硫酸软骨素存在一定的口服吸收。因此,“天然多糖口服后能否被吸收?能否入血?”一直是糖科学领域富有争议且亟需解决的重大科学问题。
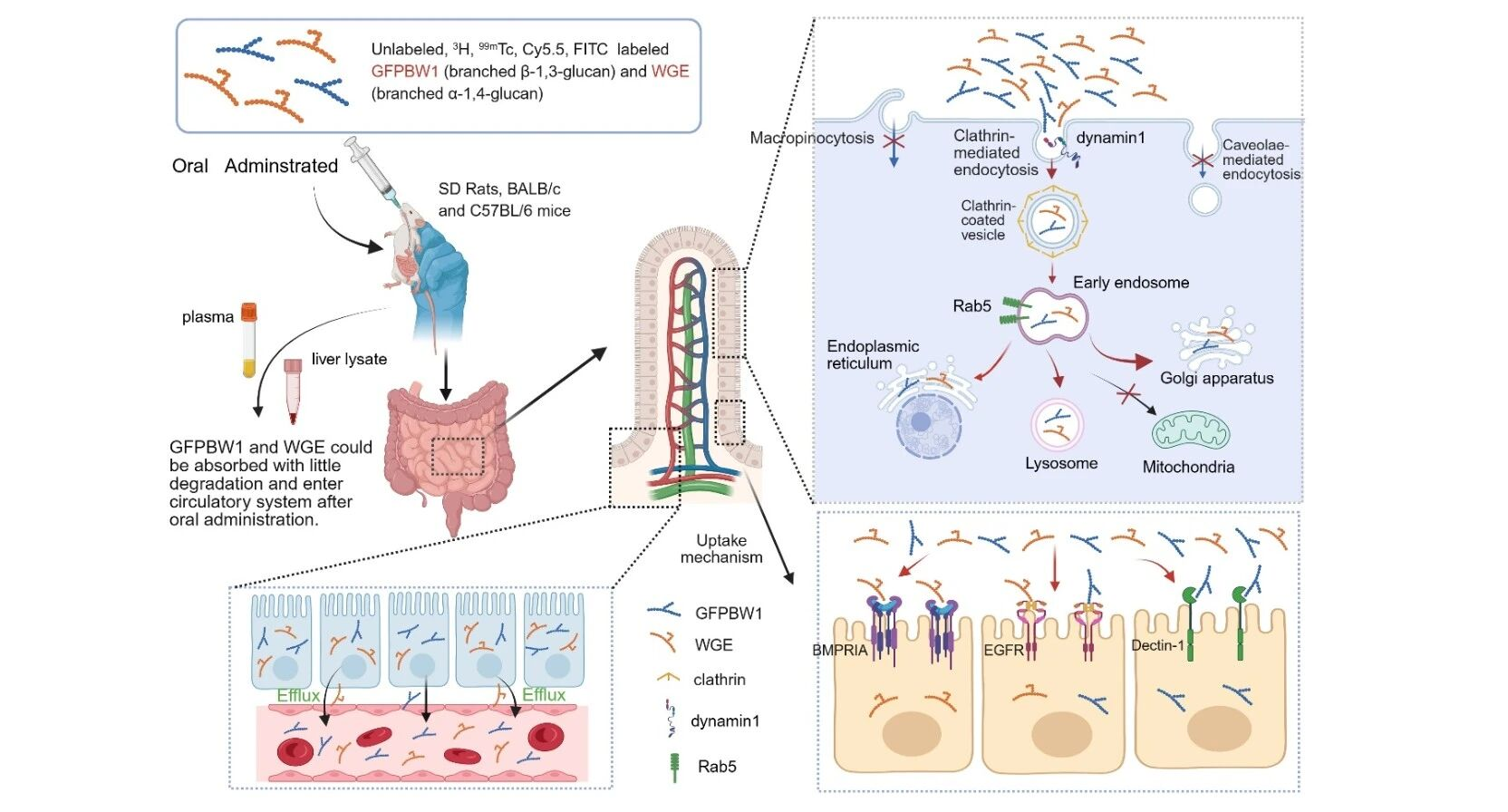
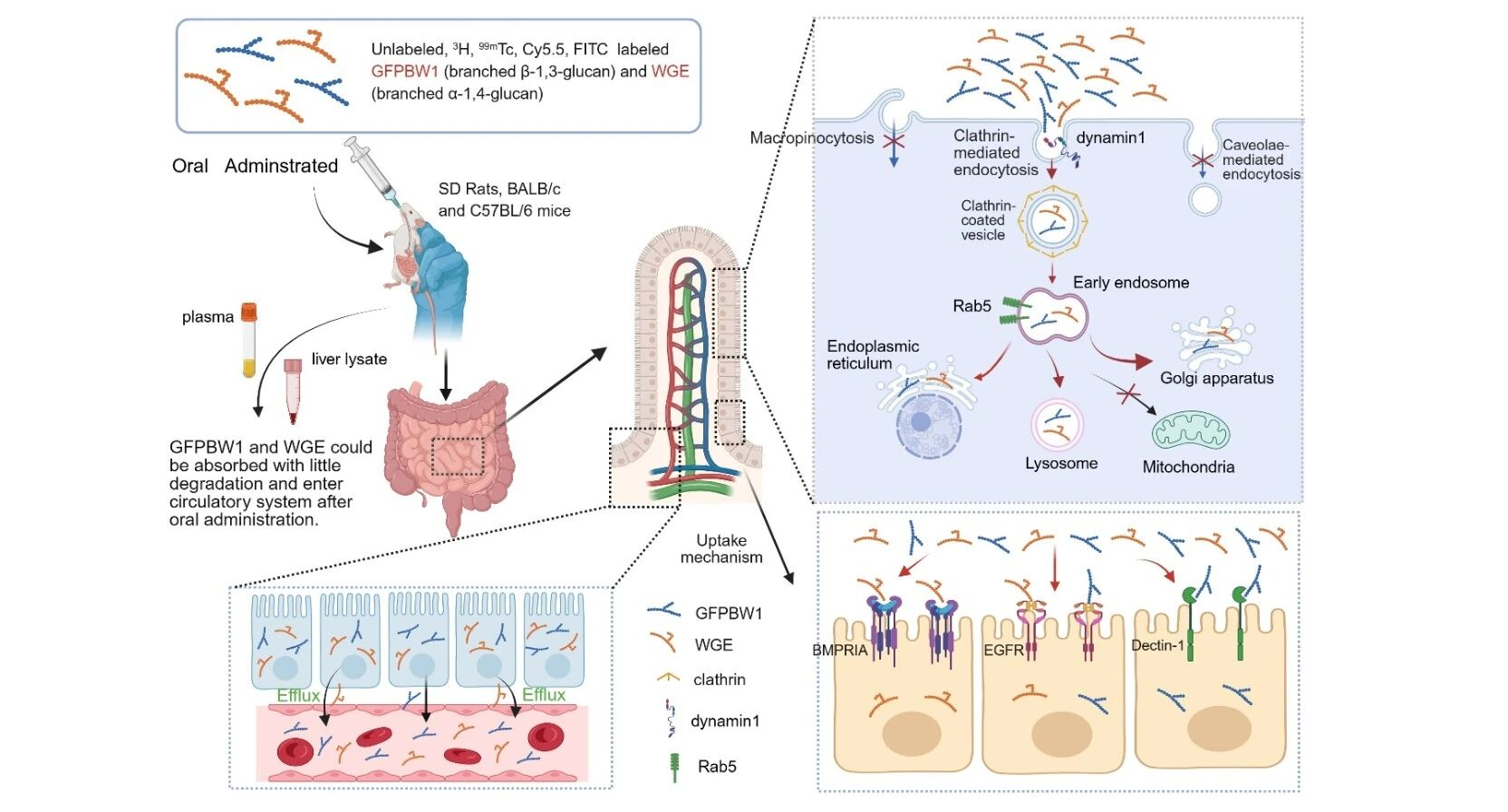
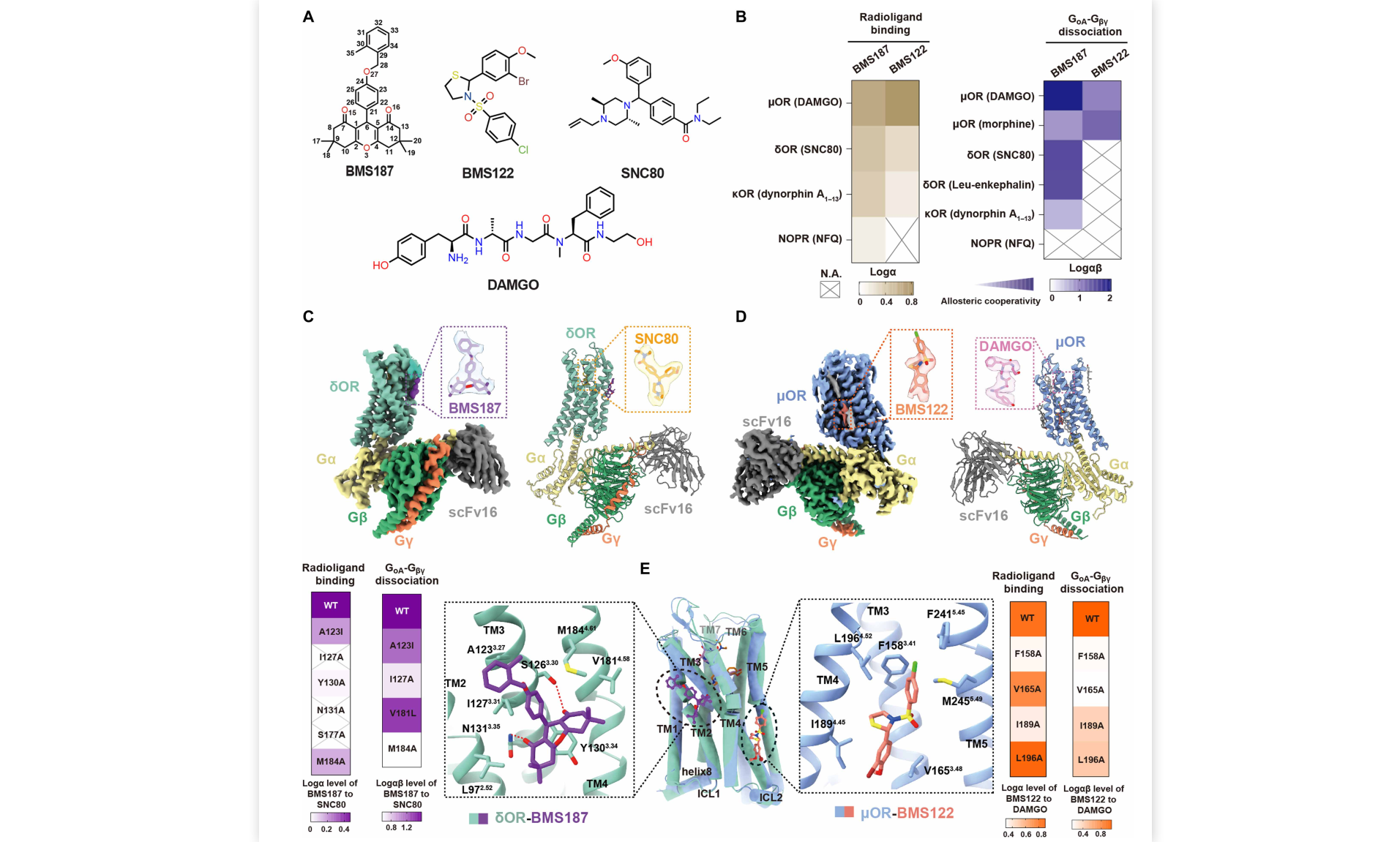
2026年1月26日,中国科学院上海药物研究所丁侃团队联合华中科技大学王凯平团队、上海药物研究所刁星星团队,陈浩团队在Nature Communications上发表了肠道细胞通过网格蛋白/动力蛋白1及Rab5介导的内吞途径吸收天然来源多糖的研究成果“1,3-and 1,4-linked polysaccharides uptake in intestinal cells relies on clathrin/dynamin1/Rab5-dependent endocytosis”。该研究突破“天然多糖口服后不能被肠道吸收”的传统观念,首次系统证实不同连接方式、带不同电荷的多糖均能以大分子形式透过体外Caco-2细胞单层,且表现渗透系数均大于1 × 10-6cm/s,提示所试多糖均具备潜在的体内吸收能力。
随后,该研究以灰树花来源的带支链β-1,3-葡聚糖GFPBW1和天麻来源带支链的α-1,4-葡聚糖WGE作为模型多糖,综合运用未标记、同位素标记(99mTc、3H)及荧光标记(Cy5.5, FITC)三种独立策略,发现天然多糖经大鼠和小鼠口服后能以大分子形式进入血液循环及肝脏, 并分布于肝脏,肾脏,胆囊等器官。研究通过抑制剂处理、免疫荧光染色及基因敲减实验,揭示天然多糖在肠道上皮细胞中的摄取依赖于由网格蛋白(CLTC)、动力蛋白1(DNM1)及Rab5介导的内吞途径,且被细胞摄取后的多糖主要定位于早期内含体、高尔基体、内质网及溶酶体。
更为重要的是,研究团队构建了网格蛋白小肠上皮细胞特异性敲除小鼠(CLTC CKO),Rab5全基因敲除小鼠(RAB5A KO)及DNM1全基因敲除小鼠(DNM1 KO),发现相比于对照组小鼠(CLTCflox/flox),多糖在CLTC CKO小鼠肠道的摄取量急剧下降;并且RAB5A KO小鼠及DNM1 KO小鼠,其肠道吸收多糖的能力也显著受损。除通用的内吞机制,不同的结构的多糖可能被特定的细胞膜受体识别。该研究进一步发现,表皮生长因子受体(EGFR)对两种模型多糖的摄取,骨形态发生蛋白受体IA型(BMPRIA)对WGE的摄取、Dectin-1受体对GFPBW1的摄取具有关键调控作用,且两种模型多糖的摄取还受wnt/β-catenin及NF-κB信号通路的调控。这些发现进一步说明天然多糖在肠道的摄取可能是一个通用机制与特异性受体介导相结合,且受相关信号通路调节的复杂而精细的过程。
上述发现不仅从分子机制上解释了为何一些口服多糖类药物能够起效,为临床长期使用的口服多糖类药物提供了药代动力学上的理论支撑,也为未来口服多糖类创新药物的研发奠定了理论基础。通过调控内吞通路或利用特定受体,有望提高多糖类药物的口服生物利用度,从而有望将更多安全有效天然多糖活性分子研发转化为服用方便的有效临床药物。
上海药物所丁侃组副研究员廖文锋、丁侃组已出站博士后曹殿秀、丁侃组已毕业博士生王滢为本文共同第一作者。上海药物所丁侃研究员,华中科技大学王凯平教授,上海药物所刁星星研究员、陈浩研究员为本文的共同通讯作者。该研究得到了国家自然科学基金、科技部重点研发计划、临港实验室、广东省科技厅新型研发机构建设项目和高水平创新研究院等项目的支持以及中山市科技局、无限极(中国)有限公司的资助。FITC标记多糖体内分析部分得到上海中医药大学王源副研究员、吴飞副研究员的大力支持,石英晶体微天平分析部分得到西北农林科技大学裴志超教授、裴玉新教授的帮助。
全文链接:https://www.nature.com/articles/s41467-026-68542-w
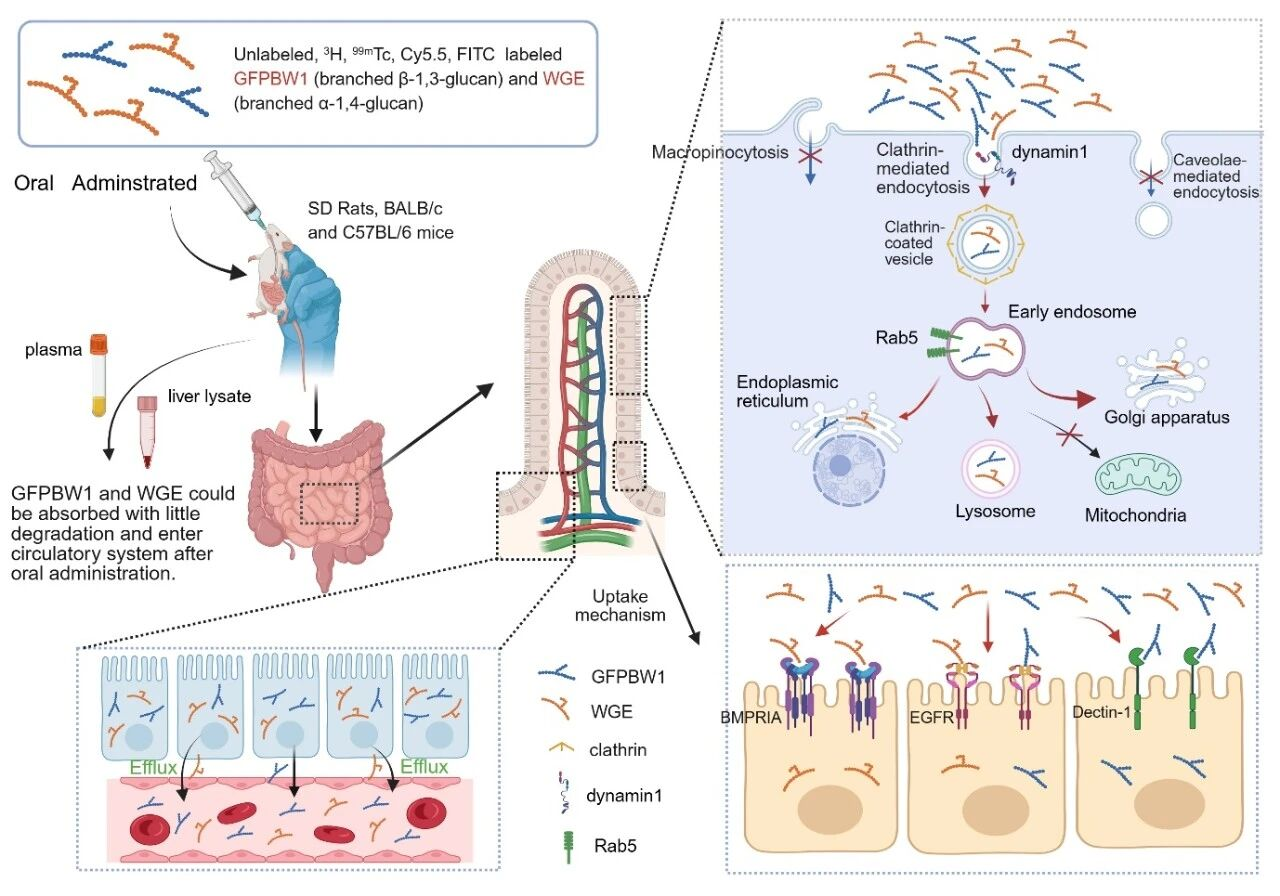
天然多糖的口服吸收和跨膜转运机制
(供稿部门:丁侃课题组;供稿人:廖文锋)