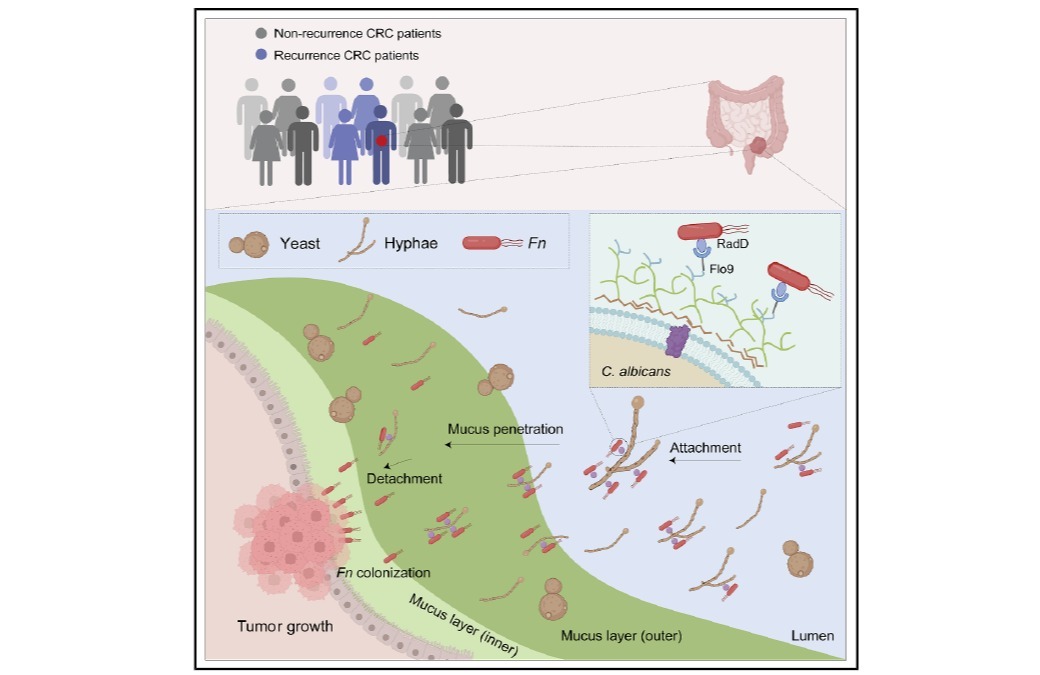
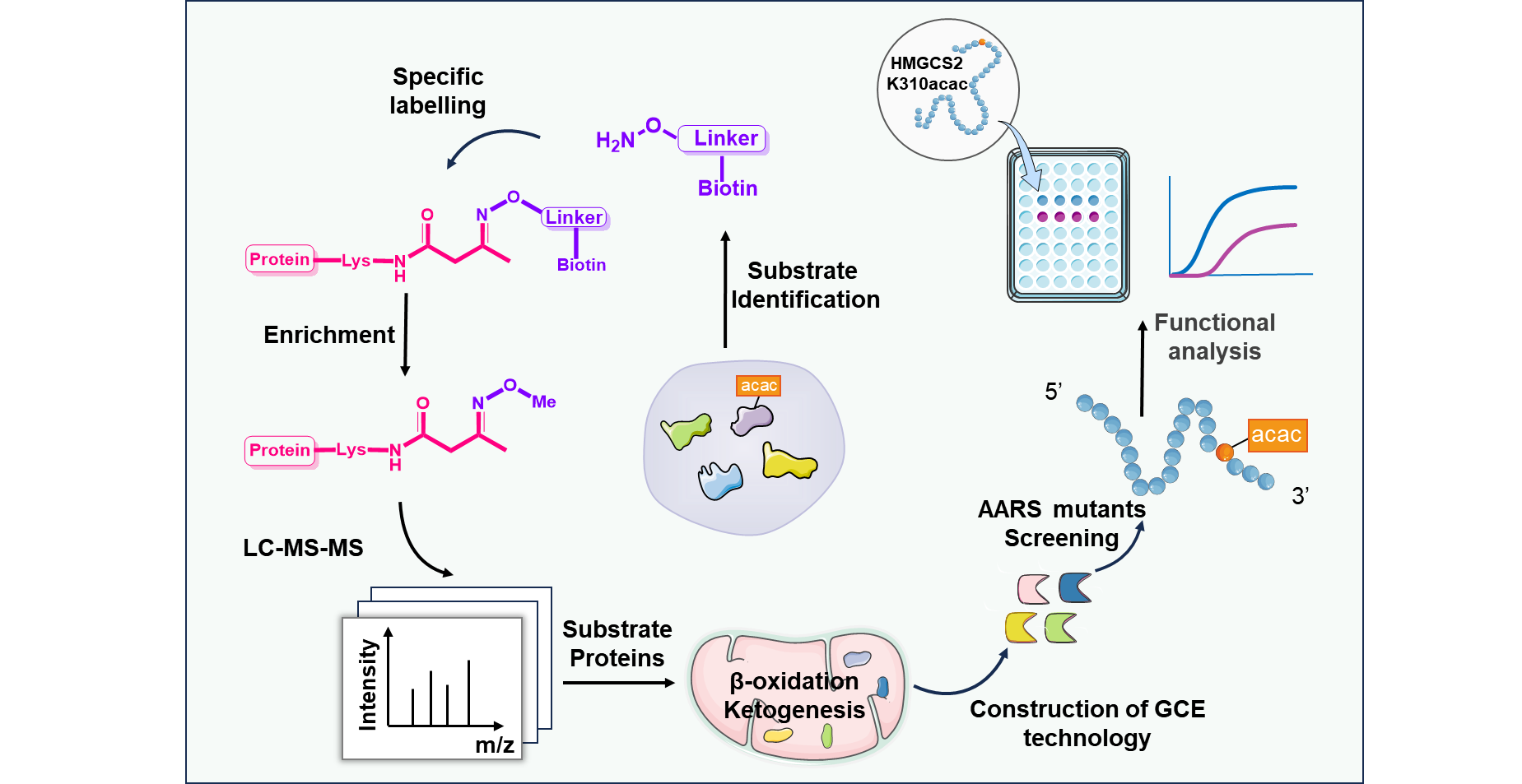
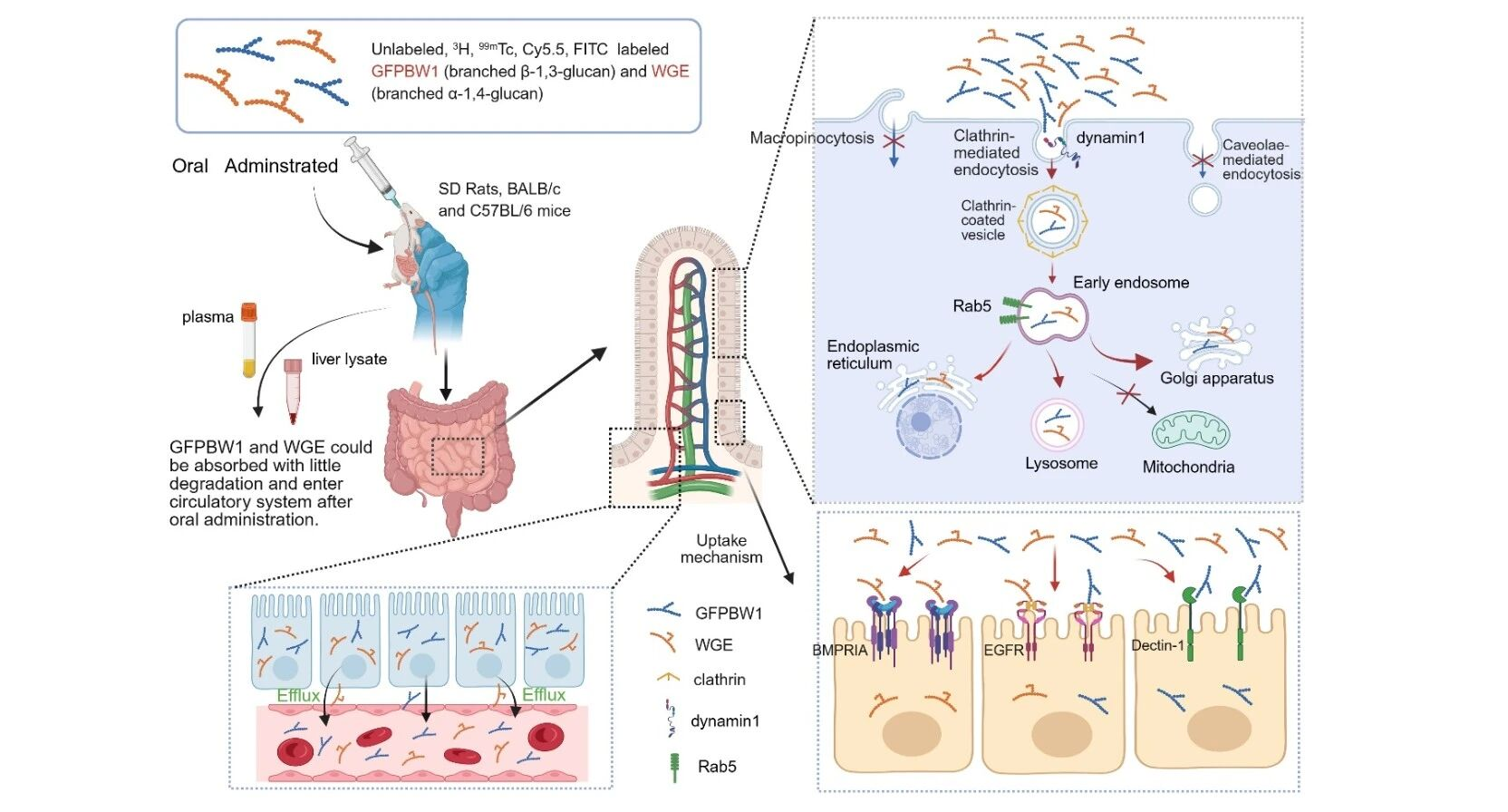
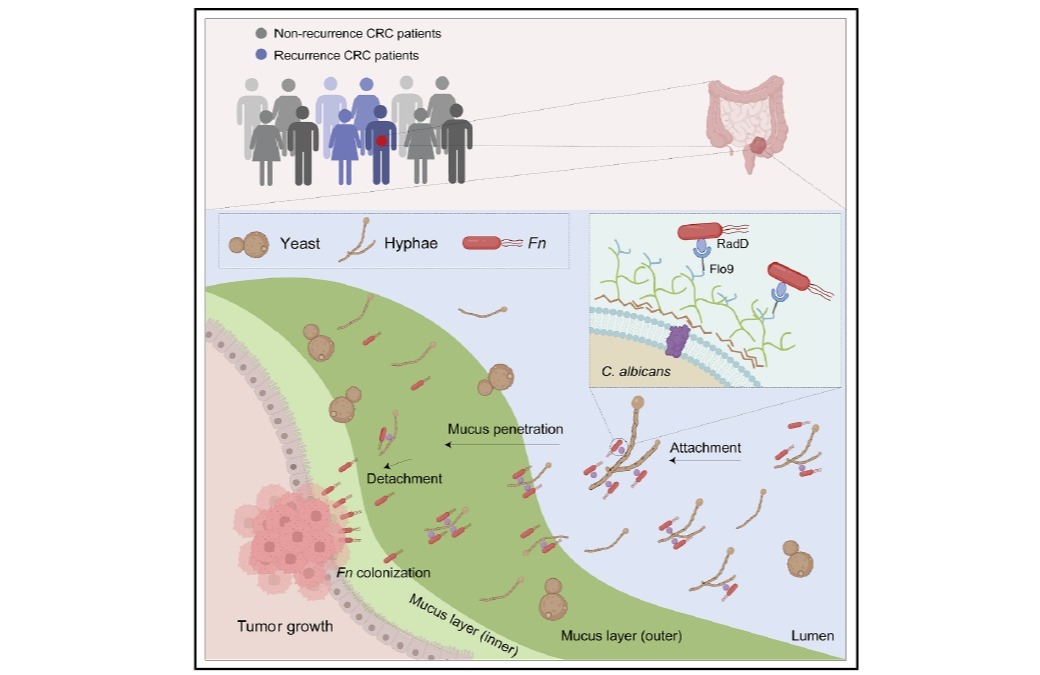
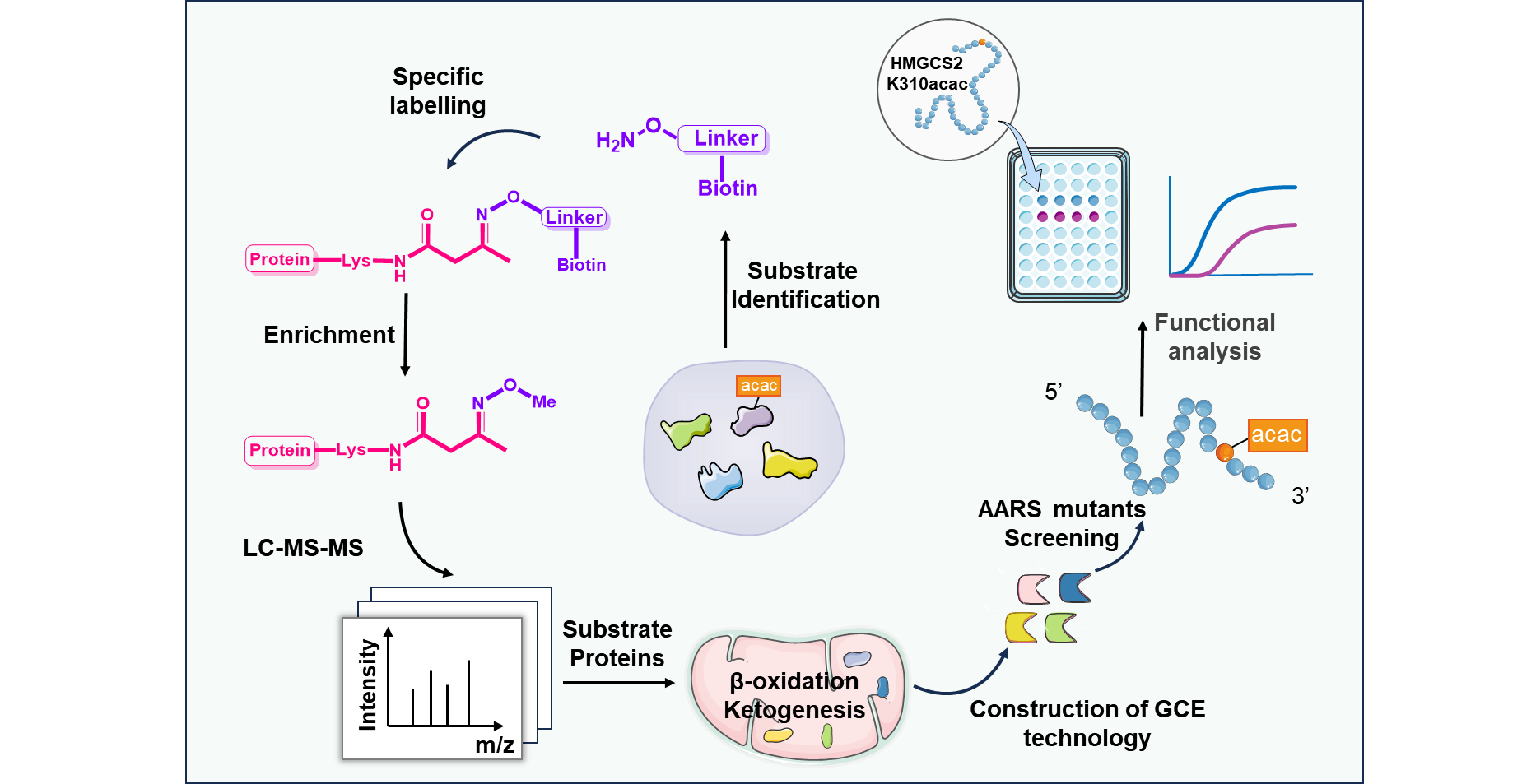
【澎湃新闻网】全国政协委员陈凯先建议设新药审批分中心

全国政协委员、中科院院士、上海市科协主席陈凯先
在今年的全国两会会场里,科技创新成为一大热门话题,而多位医疗界的全国政协委员,都将矛头对准了审批机制的改革。“如果不改进的话,就会造成科研工作做得很辛苦,虽然起步很早,但却落在了国际后面。”在沪全国政协委员、中科院院士、上海市科协主席陈凯先向澎湃新闻记者表示,以医疗领域为例,现在的机制令新药的审批速度太慢,往往需要五年到十年,而一些恶性肿瘤病人的生命根本就等不及,“只有体制机制上的创新才能推动科研创新。”
医药创新等在审批上的时间太长
“我们现在一个药要上临床,实验室做完后,要拿到医院去使用、评价,从一期到三期临床,这个过程每期都要审批一次。”陈凯先说,在他面前,看到的是每天都有大量恶性肿瘤病人在死亡,而或许能够挽回他们生命的新药还在审批的路上。他记得,美国前几年有一个治疗黑色素瘤的药物,只用了三个半月就审批完成,而这在国内目前还无法实现。
对此,另一位来自医疗界的在沪全国政协委员、上海市心血管病研究所所长葛均波也有着切身的体会。“在以色列,科研成果可以很快地变产品,但我们的一个成果要变成产品太难了,要经过非常多的程序,作为医生有时候只能看着病人一天天走向死亡。”葛均波参与研究的一种医用可降解支架,从2005年开始做动物实验,到现在还在二期临床阶段,他预计至少要在2016年底才能投入应用,这期间需要漫长的12年。
“国内的医药创新要走到临床上很难,国外的产品反而容易进来。”葛均波分析,美国FDA(食品药品监督管理局的简称)有几千人,而中国类似的机构工作人员人数很少,要收集资料,要请专家审批,还要花很长时间论证,一次审批就要半年甚至一年。“许多时候科研工作者将大量时间用于来回递交材料,补充周边信息方面,导致无端增加大量时间成本。”葛均波说。对此,陈凯先也表示赞同,一般一个药的审批,四到五年是等在审批上的,他认为审批慢的一个原因,是编制内的人数太少,而且体制机制上也缺少突破。
建议设新药审批分中心
陈凯先认为,眼下急需解决国家新药审批人员编制少的问题,可以考虑在一些在科技创新集中的地方成立分中心,一些国际上通用的,体制上突破的办法可率先实施。
“例如,有些的新药可能有潜在风险,所以要进行长期试验,看它五年十年后是否有副作用,但有些恶性肿瘤生存期很短,病人每天在大量死亡,那么考虑获益和风险的比例,是不是能有一个特殊的政策,可以让这些药先行使用起来。”陈凯先认为。同时,对于一些专家意见一致、国家上类似先例的药物,也可以走快速审批程序。
陈凯先在递交的提案中具体建议,希望在上海张江率先设立这样的分中心,借鉴国外成熟的做法,突破现有的机制。“这样有体制上的优势,全国各地新药创新的力量会自觉地向张江集中,效率也会很高,因为拖一年两年对研发的企业是很大的负担。”陈凯先表示,张江园区现有研发类,创新创业类中小型药企300多家,非常有活力,跟国际上差距也很小,有着先天优势。
葛均波认为,通过制度的改革,让科研创新具备一个良好的大环境,才有可能孕育出更多成果。他在提案中建议,在审核科研项目时,加强对于同行评议制度的建设,优化审批机制,真正做到专家评审、专家验收,而不是由政府官员拍着脑袋决定。这样,才能不让具有潜力的科研项目成为遗珠之憾,也不让重复性、低质量的科研项目耗费大量资源。对那些临床上很需要的产品,应该有专门的快速通道。
葛均波同时提出,由于历史的原因,我国大部分科技工作者的科研成果都被视为职务发明,所在机构是科研成果的拥有主体。这虽然具有一定合理性,但也会在一定程度上挫伤科研工作者的积极性。参照国外的经验,科学家可以通过合法的手段享受到成果转化带来的收益,因此建议科技部、卫计委能够发文鼓励各级科研单位改革科研创新成果的分配机制,让改革的成果能够惠及科学家。(澎湃新闻记者 姜丽钧 2015年3月8日)